题目内容
19.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液的PH相比较(相同温度下)( )| A. | 前者大 | B. | 相等 | C. | 后者大 | D. | 不能肯定 |
分析 碳酸根为多元弱酸根离子,多元弱酸根离子第一步水解程度远远大于第二步水解程度,以此解答.
解答 解:碳酸根为多元弱酸根离子,Na2CO3存在两步水解,NaHCO3只有一步水解,Na2CO3的水解程度大于NaHCO3,所以等物质的量浓度的Na2CO3溶液和NaHCO3溶液,相同浓度的CO32-水解程度大于HCO3-的水解程度,Na2CO3的PH大于NaHCO3,
故选:A.
点评 本题以钠的化合物为载体考查了pH大小的比较,涉及盐类水解等知识,侧重于学生的分析能力的考查,明确盐类水解规律是解题关键,注意相关基础知识的积累,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
6.下列对有机物(结构如图)的叙述中,不正确的是( )
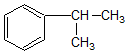

| A. | 它不能使溴水褪色也不能使酸性KMnO4溶液褪色 | |
| B. | 在FeBr3作催化剂时与Br2发生取代反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
7.往一个体积不变的密闭容器中充入H2和I2发生反应H2(g)+I2(g)?2HI(g)△H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是( )
| A. | 容器内气体颜色变浅,平均相对分子质量不变 | |
| B. | 平衡不移动,混合气体密度增大 | |
| C. | H2的转化率增大,HI平衡浓度变小 | |
| D. | 改变条件前后,速率图象如图 |
14.0.1molNa2SO4溶解在多少毫升水中,才能使每100个水分子中含有一个Na+离子( )
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 电解精炼铜时,当阴极析出32g铜时,转移电子数小于NA | |
| B. | 常温下,1.0L 1.0 mol/LNaAlO2溶液中含有的氧原子数为2NA | |
| C. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 | |
| D. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
11.纳米材料粒子的直径为1-100nm.下列分散系中分散质的微粒直径和纳米材料属于相同数量的是( )
| A. | 溶液 | B. | 悬浊液 | C. | 胶体 | D. | 乳浊液 |
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.