题目内容
10. 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.(1)已知反应Ⅰ:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)=CO(NH2)2 (s)+H2O(g)△H=+116.5kJ/mol
反应Ⅲ:H2O(l)=H2O(g)△H=+44.0kJ/mol
则工业上以二氧化碳、氨为原料合成化肥尿素和液态水的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87kJ/mol.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①0~4分钟在A催化剂作用下,反应速率υ(N2)=0.3125mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,Ksp[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.76×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)?(NH3)2+ (aq),该反应平衡常数的表达式为KC=$\frac{Ag(N{H}_{3}{)_{2}}^{+}}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$.
②计算得到可逆反应AgCl (s)+2NH3(aq)?Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=1.936×10-3(本空保留4位有效数字),1L 1mol/L氨水中最多可以溶解AgCl0.044mol(本空保留2位有效数字).
(4)工业上可以以氨、丙烯和空气为原料,在一定条件下合成丙烯腈(CH2=CH-CN),该反应的化学方程式为2CH2=CH-CH3+2NH3+3O2→2CH2=CH-CN+6H2O.丙烯腈溶于足量稀硫酸中可生成丙烯酸(CH2=CH-COOH)和硫酸铵,该反应的离子方程式为CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
分析 (1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(2)①已知4分钟时氮气为2.5mol,根据v(N2)=$\frac{△c}{△t}$计算;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.催化剂改变反应速率不改变化学平衡;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)①平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$×$\frac{A{g}^{+}}{Ag+}$=Ksp(AgCl)×K稳计算,;1L 1mol/L氨水中最多可以溶解AgCl可以依据化学平衡常数计算;
(4)氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2═CH-CN)的方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;丙烯腈溶于足量稀硫酸中可生成丙烯酸(CH2=CH-COOH)和硫酸铵,该反应的离子方程式为CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
解答 解:(1)①2NH3(g)+CO2(g)→NH2CO2 NH4(s)+l59.5kJ•mol-1
②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)-116.5kJ•mol-1
③H2O(l)→H2O(g)-44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=$\frac{△c}{△t}$=$\frac{\frac{2.5mol}{2L}}{4min}$═0.3125mol•L-1•min-1,
故答案为:0.3125mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①Ag+(aq)+2NH3(aq)=Ag(NH3)2+(aq),该反应平衡常数的表达式=$\frac{Ag(N{H}_{3}{)_{2}}^{+}}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;
故答案为:$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$;
②可逆反应AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数 K=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$×$\frac{A{g}^{+}}{Ag+}$=Ksp(AgCl)×K=1.76×10-10×1.10×107=1.936×10-3,设溶解的AgCl物质的量为x,反应前后系数相同,可以用物质的量代替平衡浓度计算平衡常数,
AgCl (s)+2NH3(aq)=Ag(NH3)2+(aq)+Cl-(aq),
依据平衡常数=$\frac{c(C{l}^{-})c(Ag(N{H}_{3}{)_{2}}^{+})}{{c}^{2}(N{H}_{3})}$=$\frac{{x}^{2}}{(1-2x)^{2}}$=1.936×10-3,
1-2x≈1,计算得到x=0.044mol,
故答案为:1.936×10-3,0.044;
(4)由氨、丙烯和空气为原料,一定条件下合成丙烯腈方程式为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;丙烯腈溶于足量稀硫酸中可生成丙烯酸(CH2=CH-COOH)和硫酸铵,该反应的离子方程式为CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
故答案为:2CH2=CH-CH3+2NH3+3O2→CH2=CH-CN+6H2O;CH2=CH-CN+2H2O+H+→CH2=CH-COOH+NH4+.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用、化学平衡影响因素分析判断、平衡常数和溶度积常数计算的应用、反应速率计算、平衡状态的判断等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如表所示.
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
②方法II发生反应的化学方程式为4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O.
(2)氢化亚铜是一种红色同体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示.
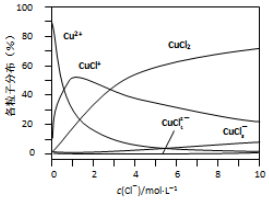
①当c(C1-)=9mol/L时,溶液中3种主要含铜微粒浓度的大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(C1-)=l mol/L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为CuCl++Ag+=Cu2++AgCl↓.
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp=2.0×10-20.则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9.
| A. | 工厂排放 CO2会导致酸雨的形成 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”,这与化学变化有关 |
(1)比较a>b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达平衡后,放出热量dkJ,则d>b(填>、=、<).
(5)在一定温度下,向一个容积不变的容器中,通入3molA2 和2molB2及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4molA2、3molB2、2molC3,则平衡时A2的转化率变大(填“不变”、“变大”、“变小”或“不能确定”)
(6)碳酸锶广泛应用于电子工业.以天青石(主要成分为SrSO4)为基本原料制备碳酸锶.(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10.)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为:SrSO4+CO32-═SrCO3+SO42-.
②当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,c(SO42-)=2.91mol/L.
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
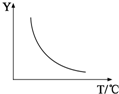
(2)实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示CO2或H2的百分含量(或其浓度、质量、物质的量等合理答案即可).
(3)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO ) 不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)由此可以判断此时的温度为830℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”).
(5)若在该条件下,将0.4mol CO与0.2mol H2O(g)混合加热到830℃下达到平衡.平衡时CO的转化率33.3%.
| A. | 前者大 | B. | 相等 | C. | 后者大 | D. | 不能肯定 |

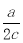 L C.ac L D.2ac L
L C.ac L D.2ac L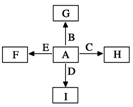 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物. ,它的空间构型是直线型分子;
,它的空间构型是直线型分子;