题目内容
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 电解精炼铜时,当阴极析出32g铜时,转移电子数小于NA | |
| B. | 常温下,1.0L 1.0 mol/LNaAlO2溶液中含有的氧原子数为2NA | |
| C. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 | |
| D. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
分析 A.32g铜的物质的量为0.5mol,得到0.5mol铜需要转移1mol电子;
B.偏铝酸钠水溶液中,除了偏铝酸钠本身,水中也含氧原子;
C.干冰分子式是CO2,葡萄糖分子式是C6H12O6,等物质的量的干冰和葡萄糖中所含碳原子数之比等于分子式碳原子数目之比、氧原子数之比等于分子式中氧原子数目之比;
D.铁与水蒸气反应生成四氧化三铁,四氧化三铁中铁元素的平均化合价为$\frac{8}{3}$价,根据电子守恒计算出生成氢气的物质的量.
解答 解:A.32g铜的物质的量为0.5mol,生成0.5mol铜需要得到1mol电子,根据电子守恒,转移电子数为NA,故A错误;
B.偏铝酸钠水溶液中,除了偏铝酸钠本身,水中也含氧原子,故溶液中的氧原子的个数大于2NA个,故B错误;
C.干冰分子式是CO2,葡萄糖分子式是C6H12O6,等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,所含氧原子数之比为2:6=1:3,故C正确;
D.铁与水蒸气的反应产物为四氧化三铁,四氧化三铁中铁元素的平均化合价为$\frac{8}{3}$价,0.10mol铁粉完全反应失去电子的物质的量为:0.10mol×$\frac{8}{3}$=$\frac{4}{15}$mol,生成氢气的物质的量为:$\frac{2}{15}$mol,生成氢气的分子数为$\frac{2}{15}$NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.

练习册系列答案
相关题目
15. 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
(1)实验1中,平衡常数K=0.9;v(H2)=0.15mol/(L•min)该反应的正反应为吸(填“吸”或“放”)热反应;
(2)实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强
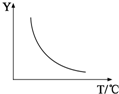
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示CO2或H2的百分含量(或其浓度、质量、物质的量等合理答案即可).
(3)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO ) 不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)由此可以判断此时的温度为830℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”).
(5)若在该条件下,将0.4mol CO与0.2mol H2O(g)混合加热到830℃下达到平衡.平衡时CO的转化率33.3%.
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
(2)实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强
(答一种情况即可);若该反应符合图所示的关系,则在图中Y轴表示CO2或H2的百分含量(或其浓度、质量、物质的量等合理答案即可).
(3)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO ) 不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O)由此可以判断此时的温度为830℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”).
(5)若在该条件下,将0.4mol CO与0.2mol H2O(g)混合加热到830℃下达到平衡.平衡时CO的转化率33.3%.
12.下列仪器中:①启普发生器②分液漏斗③滴定管④容量瓶⑤洗气瓶⑥胶头滴管,在使用前需要检验是否漏水的是( )
| A. | ①②⑥ | B. | ③④ | C. | ①②③④ | D. | ④⑤⑥ |
19.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液的PH相比较(相同温度下)( )
| A. | 前者大 | B. | 相等 | C. | 后者大 | D. | 不能肯定 |
13.将A气体通入BaCl2溶液,未见沉淀生成,然后通入B气体,有沉淀生成,再加入过量的稀盐酸后沉淀消失,则A、B气体可能是( )
| A. | SO2、H2S | B. | SO2、NO2 | C. | CO2、NH3 | D. | SO2、Cl2 |
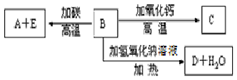 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳中含量仅次于氧的非金属元素的单质.