题目内容
19.一定条件下,可逆反应2SO2(g)+O2(g)?2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是( )| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
分析 化学平衡研究的对象为可逆反应,化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:该题2SO2(g)+O2(g)?2SO3(g)是一个可逆反应.假设SO2(g)和O2(g)全部转化为SO3(g),
2SO2(g)+O2(g)?2SO3(g)
初始 0.2mol?L-1 0.15mol?L-1 0.2mol?L-1
变化 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
终了 0 0.05mol?L-1 0.4mol?L-1
假设SO3(g)全部转化为SO2(g)和O2(g)
2SO2(g)+O2(g)?2SO3(g)
初始 0.2mol?L-1 0.15mol?L-1 0.2mol?L-1
变化 0.2mol?L-1 0.1mol?L-1 0.2mol?L-1
终了 0.4mol?L-1 0.25mol?L-1 0
该反应是一个可逆反应,无论向正反应方向进行还是向逆反应方向进行,实际不可能100%转化,
根据分析可知:0<c(SO2)<0.4mol?L-1 ,0.05mol?L-1<c(O2)<0.25mol?L-1 ,0<c(SO3)<0.4mol?L-1 ,
A.c(SO2)=0.1mol/L满足0<c(SO2)<0.4mol?L-,符合条件,故A正确;
B.c(O2)=0.05mol/L不在范围内,不符合条件,故B错误;
C.c(SO3)=0.5mol/L不在范围内,不符合条件,故C错误;
D.c(SO2)=0.4mol/L不在范围内,不符合条件,故D错误;
故选A.
点评 本题考查可逆反应特点,题目难度不大,利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度,试题侧重考查学生的分析能力及化学计算能力.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | 2,2-二甲基丙醇和2-甲基丁醇 | B. | 邻氯甲苯和对氯甲苯 | ||
| C. | 2-甲基丁烷和戊烷 | D. | 乙酸乙酯和丙酸丙酯 |

| A. | 羟氨苄青霉素在空气中不能很稳定地存在 | |
| B. | 每个羟氨苄青霉素分子中含有3个手性碳原子 | |
| C. | 羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 | |
| D. | 羟氨苄青霉素可以与FeCl3发生显色反应 |
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出A、B、C、D、E的化学式:A:NaHCO3、B:KNO3、C:KAl(SO4)2、D:CuSO4 E:NaOH
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
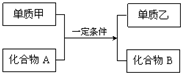 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题: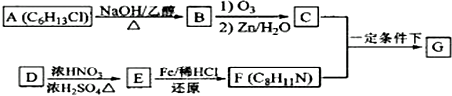


 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).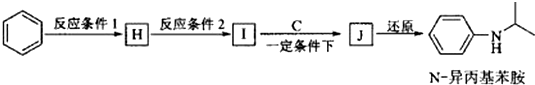
 .
.