题目内容
18.孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤.常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是( )| A. | 加入过量氨水:Fe3+、NH4+、SO42-、OH- | |
| B. | 加入过量NaClO溶液:Fe2+、H+、Cu2+、SO42- | |
| C. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| D. | 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3- |
分析 孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),加入过量硫酸溶解后过滤,SiO2不反应,则滤液中含有的离子为:Cu2+、Fe3+、Fe2+、Al3+、SO42-、H+,
A.铁离子与氨水反应;
B.NaClO能够氧化亚铁离子;
C.铜离子、铁离子、亚铁离子都与氢氧化钠溶液反应生成沉淀,铝离子反应生成偏铝酸根离子;
D.铝离子与碳酸氢根离子发生双水解反应.
解答 解:孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),加入过量硫酸溶解后过滤,SiO2不反应,则滤液中含有的离子为:Cu2+、Fe3+、Fe2+、Al3+、SO42-、H+,
A.加入过量氨水后,Fe3+与氨水反应生成氢氧化铁沉淀,反应后溶液中不会大量存在Fe3+,故A错误;
B.NaClO具有强氧化性,能够氧化Fe2+,反应后溶液中不会大量存在Fe2+,故B错误;
C.加入过量NaOH溶液后,Cu2+、Fe3+、Fe2+反应生成难溶物,Al3+反应生成AlO2-,所以反应后溶液中存在离子为Na+、AlO2-、SO42-、OH-,故C正确;
D.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以反应后溶液中不会大量存在Al3+,故D错误;
故选C.
点评 本题考查离子共存的应用,为高考的高频题,明确滤液组成为解答关键,注意把握物质的性质以及反应类型的判断,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
2. 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 乙醇钠 |
13.物质的性质决定其用途.下列说法正确的是( )
| A. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| B. | 氯化铝是强电解质,可电解其水溶液获得金属铝 | |
| C. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
3.根据下列实验操作和现象得出的结论不合理的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将乙醇加入酸性重铬酸钾(K2Cr2O7)溶液中 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
| C | 将光亮的镁条放入NH4Cl溶液中 | 有大量气泡产生 | 反应生成H2和NH3 |
| D | 将NaAlO2溶液加入NaHCO3溶液中 | 有白色沉淀生成 | AlO2-结合H+的能力比HCO3-强 |
| A. | A | B. | B | C. | C | D. | D |
10.2016年是门捷列夫诞生辰182周年,门捷列夫在化学史上的贡献是( )
| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |



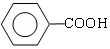
 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
+
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
.