题目内容
17.巧妙的实验设计有助于更好地解决问题.下列装置不能达到实验目的是( )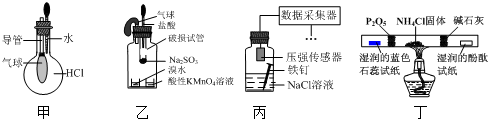
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
分析 A.HCl极易溶于水,挤压胶头滴管,气球变大;
B.生成的二氧化硫与溴水或高锰酸钾均发生氧化还原反应;
C.NaCl溶液为中性,发生吸氧腐蚀,瓶内压强减小;
D.NH4Cl分解生成氨气、HCl,氨气可使酚酞试纸变蓝,HCl可使湿润的蓝色石蕊试纸变红,五氧化二磷、碱石灰均可除杂.
解答 解:A.HCl极易溶于水,挤压胶头滴管,气球变大,则装置甲可验证HCl气体易溶于水,故A正确;
B.生成的二氧化硫与溴水或高锰酸钾均发生氧化还原反应,可验证其还原性,与漂白无关,故B错误;
C.NaCl溶液为中性,发生吸氧腐蚀,瓶内压强减小,则装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀,故C正确;
D.NH4Cl分解生成氨气、HCl,氨气可使酚酞试纸变蓝,HCl可使湿润的蓝色石蕊试纸变红,五氧化二磷、碱石灰均可除杂,则装置丁可检验NH4Cl分解产生的气体,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
7.图中曲线表示短周期元素的原子序数(技递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是( )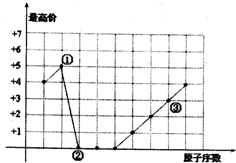

| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
8.X、Y、Z、W为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与W同周期,W的原子半径小于Z.下列叙述正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
12.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如图1实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.图2中A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得:反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,生成氮气在标准状下的体积为V1L.
乙小组测得:洗气前装置D的质量为m3g,洗气后装置D的质量为m4g,生成氮气在标准状况下的体积为V2 L.
请回答下列问题:
(1)写出仪器a的名称:圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中;用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填 写在如表的空格中.
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.
为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.图2中A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得:反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,生成氮气在标准状下的体积为V1L.
乙小组测得:洗气前装置D的质量为m3g,洗气后装置D的质量为m4g,生成氮气在标准状况下的体积为V2 L.
请回答下列问题:
(1)写出仪器a的名称:圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中;用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填 写在如表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用______ |
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.
为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)△H=-907.2kJ•mol-1K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
①4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)△H=-907.2kJ•mol-1K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
6.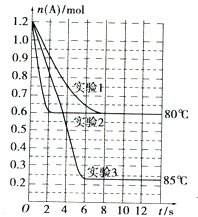 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
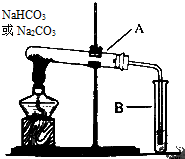 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案. 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: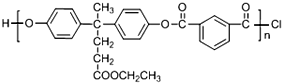
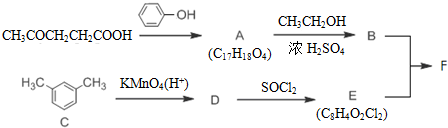
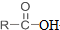 +SOCl2→
+SOCl2→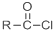 +SO2+HCl
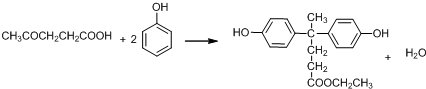
+SO2+HCl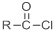 +R′OH→
+R′OH→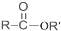 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)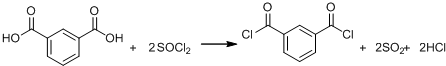 .
. .
.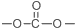 结构.
结构.