题目内容
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:①4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)△H=-907.2kJ•mol-1K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.2kJ•mol-1K=7.1×1034
下列说法正确的是( )
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
分析 A、K是温度的函数;
B、由反应②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028,可知500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=$\sqrt{4.4×1{0}^{28}}$;
C、反应N2 (g)+O2 (g)=2NO(g)△H=$-\frac{③}{2}+\frac{①}{2}$;
D、4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)是可逆反应.
解答 解:A、增大压强,则反应的②K不变,反应①和③的K不变,故A错误;
B、由反应②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1K=4.4×1028,可知500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=$\sqrt{4.4×1{0}^{28}}$,故B错误;
C、反应N2 (g)+O2 (g)=2NO(g)△H=$-\frac{③}{2}+\frac{①}{2}$=$\frac{1269.2-907.2}{2}$=+181 kJ•mol-1,故C正确;
D、4NH3 (g)+5O2(g)?4NO (g)+6H2O (g)是可逆反应,不可能完全转化,所以放出热量小于453.6 kJ,故D错误;
故选C.
点评 本题考查了化学平衡常数的影响因素和盖斯定律书写热化学方程式,题目难度中等,注意盖斯定律的应用.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
19.下列实验能达到预期目的是( )
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向油脂中加入NaOH溶液再蒸馏,提纯油脂 |
17.巧妙的实验设计有助于更好地解决问题.下列装置不能达到实验目的是( )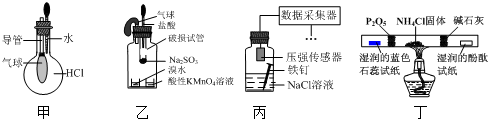

| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
4.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )
| A. |  分散系的分类 | B. | 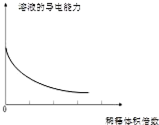 稀释浓氢氧化钠溶液的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴加盐酸 | D. |  向偏铝酸钠溶液中逐滴滴加盐酸 |
18.镇痛剂M(苯佐卡因)结构简式如图,下列说法正确的是( )
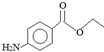

| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
18.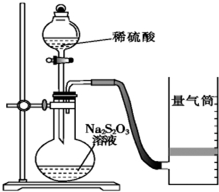 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响淀粉溶液的作用是作为显色剂,检验I2的存在.表中Vx═4ml,比较t1、t2、t3大小,试推测该实验结论:t1<t2<t3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |