题目内容
2. 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:步骤1:向废液中加入足量的NaCl溶液,将所得沉淀过滤,并洗涤干净.
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、Al(OH)3和少量仍未反应的AgCl].取出铝片,过滤并洗涤沉淀.
步骤3:…
(1)步骤1中检验所加NaCl溶液已经足量的方法是静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量.
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体.写出该过程中发生反应的离子方程式:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑.
(3)已知AgNO3和Al(NO3)3的溶解度曲线如图所示,请补充完整由步骤2中所得灰白色沉淀制取硝酸银固体的实验方案:向所得灰白色混合物中加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥,得到硝酸银晶体(实验中必须使用的试剂有:稀盐酸、稀硝酸、冰水).
(4)已知:Ag++SCN-=AgSCN↓(白色).实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应):
①称取2.000g制备的硝酸银样品,加水溶解,定容到100mL.溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有100mL容量瓶、胶头滴管.
②准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.1000mol•L-1 NH4SCN标准溶液滴定.滴定终点的实验现象为溶液变为(血)红色,且保持30s不变.
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为29.00mL.则硝酸银的质量分数为98.60%.
分析 (1)步骤1中向硝酸银中继续加NaCl溶液看是否有沉淀,可判断所加氯化钠是否足量;
(2)根据元素守恒和电荷守恒可书写步骤2中的离子方程式;
(3)步骤2中所得灰白色沉淀主要含有Ag、Al(OH)3和少量仍未反应的AgCl,可向沉淀中加入足量稀盐酸,充分反应后,过滤,洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,据此判断;
③NH4SCN标准溶液的平均体积为29.00mL,则NH4SCN的物质的量为0.1000mol•L-1×0.029L=2.9×10-3 mol,根据Ag++SCN-=AgSCN↓可求得硝酸银的质量,进而确定质量分数;
解答 解:(1)步骤1中向硝酸银中继续加NaCl溶液看是否有沉淀,可判断所加氯化钠是否足量,实验步骤为静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量,
故答案为:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量;
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体为二氧化碳,步骤2中的离子方程式为2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑,
故答案为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑;
(3)步骤2中所得灰白色沉淀主要含有Ag、Al(OH)3和少量仍未反应的AgCl,可向沉淀中加入足量稀盐酸,充分反应后,过滤,洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体,
故答案为:加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,所以滴定终点的实验现象为溶液变为(血)红色,且保持30s不变,
故答案为:溶液变为(血)红色,且保持30s不变;
③NH4SCN标准溶液的平均体积为29.00mL,则NH4SCN的物质的量为0.1000mol•L-1×0.029L=2.9×10-3 mol,根据Ag++SCN-=AgSCN↓可知硝酸银的质量为2.9×10-3 mol×170g/mol×$\frac{100}{25}$=1.972g,所以硝酸银的质量分数为$\frac{1.972g}{2.000g}$×100%=98.60%,
故答案为:98.60%.
点评 本题考查制备实验方案的设计,涉及氧化还原反应、物质的分离提纯、物质含量测定、沉淀滴定原理应用等,综合性较强,基本属于拼合型题目,题目难度中等.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 铝热反应 |
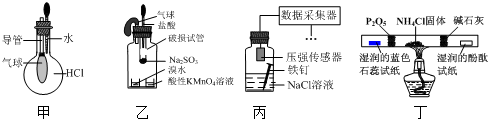
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.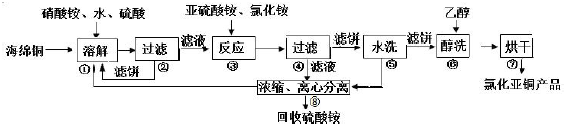
 .
.