题目内容
7.图中曲线表示短周期元素的原子序数(技递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是( )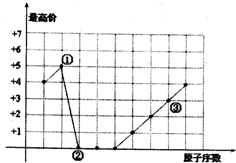
| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
分析 ①的常见最高化合价为+5价,②的常见最高化合价为0价,③的常见最高化合价为+3价,三种元素均为短周期元素,则①为N元素,②为O元素,③为Al元素;据此结合元素化合物的性质和元素周期律解答.
解答 解:①的常见最高化合价为+5价,②的常见最高化合价为0价,③的常见最高化合价为+3价,三种元素均为短周期元素,则①为N元素,②为O元素,③为Al元素;
A.①、②形成的化合物N2O的摩尔质量是44g/mol,故A正确;
B.①、③可以形成化合物AlN,原子个数比1:l,故B正确;
C.②、③形成的化合物Al2O3,氧化铝与强酸、强碱均能反应是两性物质,故C正确;
D.电子排布相同的离子,原子序数越大,离子半径越小,则单核简单离子半径大小为:O2->Al3+,故D错误.
故选D.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe有关该电池的下列中,正确的是( )
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
18.如图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
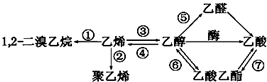

| A. | 反应①③是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④是消去反应 |
15.日常生活和工业生产中常用到漂白剂.下列物质没有漂白作用的是( )
| A. | H2O2 | B. | 新制氯水 | C. | CaCl2 | D. | SO2 |
2.pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为l×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×l0-3)=3.如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.下列说法不正确的是( )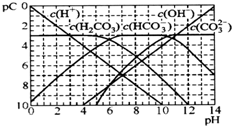

| A. | H2CO3、HCO3-、CO32-不能在同一溶液中大量共存 | |
| B. | H2CO3电离平衡常数Kal≈10-6 | |
| C. | pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | pH=9时,溶液中存在关系(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
19.下列实验能达到预期目的是( )
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向油脂中加入NaOH溶液再蒸馏,提纯油脂 |
17.巧妙的实验设计有助于更好地解决问题.下列装置不能达到实验目的是( )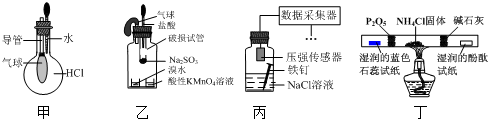

| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物. .
.