题目内容
8.X、Y、Z、W为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与W同周期,W的原子半径小于Z.下列叙述正确的是( )| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
分析 X、Y、Z、W为短周期元素,X的M电子层有1个电子,则X为Na;Y的最外层电子数为内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z的最高化合价为最低化合价绝对值的3倍,处于VIA族,由于氧元素没有+6价,则Z为S元素,Z与W同周期,W的原子半径小于Z,则W为Cl.
解答 解:X、Y、Z、W为短周期元素,X的M电子层有1个电子,则X为Na;Y的最外层电子数为内层电子数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z的最高化合价为最低化合价绝对值的3倍,处于VIA族,由于氧元素没有+6价,则Z为S元素,Z与W同周期,W的原子半径小于Z,则W为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:Y(C)<W(Cl)<Z(S)<X(Na),故A错误;
B.非金属性W(Cl)>Z(S)>Y(C),故气态氢化物的稳定性:W>Z>Y,故B错误;
C.Y、Z、W与Mg分别可以形成MgC2、MgS、MgCl2,三种都是离子化合物,故C正确;
D.Y、Z最高价氧化物对应水化物分别为碳酸、硫酸,碳酸是弱酸,而硫酸为强酸,故D错误.
故选:C.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
相关题目
18.如图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
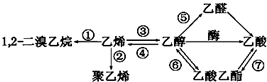

| A. | 反应①③是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④是消去反应 |
19.下列实验能达到预期目的是( )
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向油脂中加入NaOH溶液再蒸馏,提纯油脂 |
3.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
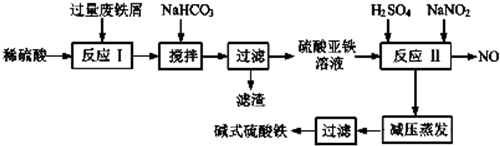
已知部分阳离子以氧氧化物形式沉淀的溶液的pH见表.回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成具有吸附能力较强的胶体.
(2)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的Al3+沉淀.
(3)假设沉淀完全溶解时溶液中金属离子的浓度为1.0×10-5mol•L-1,试估算Ksp[Fe(OH)2]=10-15.
(4)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,该反应的离子方程式为2H++Fe2++NO3-=Fe3++NO↑+H2O
(5)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有SO42-,可供选择的试剂如下:
A.新制氯水 B.0.l mol•L -1KSCN溶液
C.10%NaOH溶液 D.20%HNO3溶液
E.0.05mol•L-1酸性KMnO4溶液 F.0.1mol•L-1BaCl2溶液
请你帮助该同学完成实验,将相关项目填入表中:
(7)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:
2Fe2++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为5.6g•L-1.
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
(1)碱式硫酸铁能够净水的原因是能水解生成具有吸附能力较强的胶体.
(2)加入少量NaHCO3的目的是调节溶液的pH,使溶液中的Al3+沉淀.
(3)假设沉淀完全溶解时溶液中金属离子的浓度为1.0×10-5mol•L-1,试估算Ksp[Fe(OH)2]=10-15.
(4)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,该反应的离子方程式为2H++Fe2++NO3-=Fe3++NO↑+H2O
(5)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(6)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有SO42-,可供选择的试剂如下:
A.新制氯水 B.0.l mol•L -1KSCN溶液
C.10%NaOH溶液 D.20%HNO3溶液
E.0.05mol•L-1酸性KMnO4溶液 F.0.1mol•L-1BaCl2溶液
请你帮助该同学完成实验,将相关项目填入表中:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀 | 得红棕色溶液 | 溶液中含有Fe3+ |
| 取少量溶液于试管中,滴加0.05mol/L的酸性高锰酸钾溶液 | 溶液不褪色 | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1mol/L的氯化钡溶液,再加入20%稀硝酸溶液 | 有白色沉淀 | 溶液中含有SO${\;}_{4}^{2-}$ |
2Fe2++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为5.6g•L-1.
13.下列反应属于吸热反应的是( )
| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 铝热反应 |
17.巧妙的实验设计有助于更好地解决问题.下列装置不能达到实验目的是( )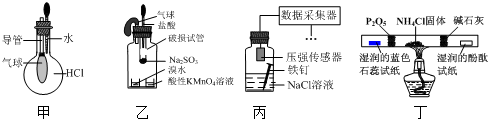

| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
18.镇痛剂M(苯佐卡因)结构简式如图,下列说法正确的是( )
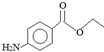

| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
 .
.