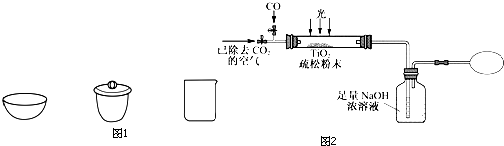
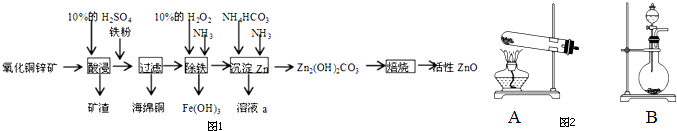
题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体.
(1)A ;D (填元素名称);
(2)写出C、D两元素形成的常见化合物的电子式 ;写出由A、B两元素形成的18电子微粒中所含化学键类型 ;
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜.在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:通入A单质的一极: ;通入B单质的一极: ;
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用.请写出化合物X吸收NO2时所发生反应的离子方程式: .
(1)A
(2)写出C、D两元素形成的常见化合物的电子式
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止气体透过的隔膜.在一极通人A的单质,另一极通人B的单质,写出该电池发生的电极反应式:通入A单质的一极:
(4)由A、B、C 三元素构成的化合物X,常在试验制备过程中起尾气吸收作用.请写出化合物X吸收NO2时所发生反应的离子方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D原子序数依次增大短周期元素,A、C及B、D分别是同一主族元素,确定B、D分别位于二、三周期;由于B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,确定A、C分别位于一、三周期,所以A为氢、C为钠、B为氧、D为硫,据此答题.
解答:
解:A、B、C、D原子序数依次增大短周期元素,A、C及B、D分别是同一主族元素,确定B、D分别位于二、三周期;由于B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,确定A、C分别位于一、三周期,所以A为氢、C为钠、B为氧、D为硫.
(1)由上述分析可知,A为氢、D为硫,故答案为:氢;硫;
(2)C和D两元素形成化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为 ,由A、B两元素形成的18电子微粒为双氧水,其中所含化学键类型为极性共价键、非极性共价键,
,由A、B两元素形成的18电子微粒为双氧水,其中所含化学键类型为极性共价键、非极性共价键,
故答案为: ;极性共价键、非极性共价键;
;极性共价键、非极性共价键;
(3)氢氧碱性燃料电池,负极发生氧化反应,氢气在负极放电,电极反应式为2H2-4e-+4OH-=4H2O,正极发生还原反应,氧气在正极放电,电极反应式O2+2H2O+4e-=4OH-,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;
(4)由A、B、C 三元素构成的化合物X为氢氧化钠,常在试验制备过程中起尾气吸收作用,氢氧化钠吸收NO2时所发生反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O,
故答案为:2NO2+2OH-=NO3-+NO2-+H2O.
(1)由上述分析可知,A为氢、D为硫,故答案为:氢;硫;
(2)C和D两元素形成化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为
 ,由A、B两元素形成的18电子微粒为双氧水,其中所含化学键类型为极性共价键、非极性共价键,
,由A、B两元素形成的18电子微粒为双氧水,其中所含化学键类型为极性共价键、非极性共价键,故答案为:
 ;极性共价键、非极性共价键;
;极性共价键、非极性共价键;(3)氢氧碱性燃料电池,负极发生氧化反应,氢气在负极放电,电极反应式为2H2-4e-+4OH-=4H2O,正极发生还原反应,氧气在正极放电,电极反应式O2+2H2O+4e-=4OH-,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;
(4)由A、B、C 三元素构成的化合物X为氢氧化钠,常在试验制备过程中起尾气吸收作用,氢氧化钠吸收NO2时所发生反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O,
故答案为:2NO2+2OH-=NO3-+NO2-+H2O.
点评:本题考查学生利用原子的结构来推断元素、常用化学用语、原电池及离子反应等,中等难度,元素推断是解题的关键也是本题的难点.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
水是生命之源、生态之基,下列关于水的描述正确的是( )
| A、H216O中,质量数之和是质子数之和的两倍 |
| B、在纯水中加入少量铵盐不会对水的电离产生影响 |
| C、100℃时,纯水的pH=7 |
D、H2O的电子式为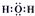 |
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”,下列有关说法中正确的是(( )
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
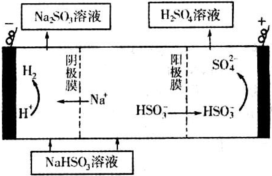 某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
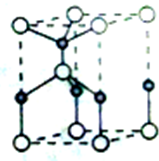 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为