题目内容
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
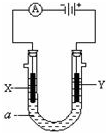
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①X是 极(填“阴”或“阳”),X极逸出 (填“黄绿色”或“无色”)气体,同时X极附近溶液呈 色.
②电解池中Y极上的电极反应式为 .X极上的电极反应式为 .
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼(得到纯铜),电解液a选用CuSO4溶液,则:
①Y电极的材料是 (填“粗铜”或“纯铜”).
②X电极的电极反应式是 .
③下列说法正确的是 .(错选不得分)
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用 ,阳极材料是用 ,阳极电极反应式为 .

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①X是
②电解池中Y极上的电极反应式为
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼(得到纯铜),电解液a选用CuSO4溶液,则:
①Y电极的材料是
②X电极的电极反应式是
③下列说法正确的是
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用
考点:电解原理
专题:
分析:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,Y为阳极电极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验,X为阴极电极上氢离子放电,同时该电极附近生成氢氧根离子,遇到酚酞试液会变红;
(2)①如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,
②X为阴极,阴极上得电子,发生还原反应;
③a.电能不能全部转化为化学能;
b.在电解精炼过程中,阳极上金属放电;
c.溶液中Cu2+向阴极移动;
d.在阳极的底部可回收不活泼金属;
(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阳极上失电子发生氧化反应.
(2)①如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,
②X为阴极,阴极上得电子,发生还原反应;
③a.电能不能全部转化为化学能;
b.在电解精炼过程中,阳极上金属放电;
c.溶液中Cu2+向阴极移动;
d.在阳极的底部可回收不活泼金属;
(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阳极上失电子发生氧化反应.
解答:
解:(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,X为阴极电极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,同时该电极附近生成氢氧根离子,遇到酚酞试液会变红,故答案为:阴极;无色;红;
②Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,X为阴极电极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)①电解精炼中,粗铜作阳极,纯铜作阴极,
Y是阳极,则Y极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:粗铜;
②X为阴极,阴极上得电子,发生还原反应;阴极上铜离子的放电能力大于氢离子的放电能力,所以阴极上析出铜,故电极反应式为Cu2++2e-═Cu;
故答案为:Cu2++2e-═Cu;
③a.电能不能全部转化为化学能,还有部分转化为热能,故错误;
b.在电解精炼过程中,阳极上金属放电,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极的底部可回收不活泼金属,如Ag、Pt、Au,故正确;
故选bd;
(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阳极上失电子发生氧化反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用铜,阳极电极反应式为Cu-2e-═Cu2+,
故答案为:硫酸溶液;铜;Cu-2e-═Cu2+.
②Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,X为阴极电极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)①电解精炼中,粗铜作阳极,纯铜作阴极,
Y是阳极,则Y极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:粗铜;
②X为阴极,阴极上得电子,发生还原反应;阴极上铜离子的放电能力大于氢离子的放电能力,所以阴极上析出铜,故电极反应式为Cu2++2e-═Cu;
故答案为:Cu2++2e-═Cu;
③a.电能不能全部转化为化学能,还有部分转化为热能,故错误;
b.在电解精炼过程中,阳极上金属放电,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极的底部可回收不活泼金属,如Ag、Pt、Au,故正确;
故选bd;
(3)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阳极上失电子发生氧化反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用铜,阳极电极反应式为Cu-2e-═Cu2+,
故答案为:硫酸溶液;铜;Cu-2e-═Cu2+.
点评:本题考查电解原理,涉及电极反应式的书写,知道离子放电顺序及电极反应式的书写方法,正确判断阴阳极及电极反应是解本题关键.

练习册系列答案
相关题目
关于工业转化图(见图),下列说法不正确的是( )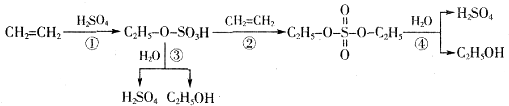

| A、该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B、从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C、该过程中①②是加成反应 |
| D、该过程中③④是酯类的水解 |
已知X、Y、Z、W四种短周期主族元素在周期表中相对位置如图所示,下列说法不正确的是( )
| X | Y |
| Z | W |
| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径小 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
25℃时,pH=2的酸和pH=12的碱溶液等体积混合后,恢复至原温,溶液呈酸性.其原因可能是( )
| A、生成了一种强酸弱碱盐 |
| B、等浓度的强酸和弱碱溶液反应 |
| C、浓的弱酸溶液和稀的强碱溶液反应 |
| D、浓的强酸和稀的强碱溶液反应 |
化学无处不在,下列与化学有关说法正确的是( )
| A、中性溶液的PH都相等 | ||||
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 | ||||
C、
| ||||
| D、△H<0,△S<0的化学反应不能自发进行 |
水是生命之源、生态之基,下列关于水的描述正确的是( )
| A、H216O中,质量数之和是质子数之和的两倍 |
| B、在纯水中加入少量铵盐不会对水的电离产生影响 |
| C、100℃时,纯水的pH=7 |
D、H2O的电子式为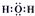 |
 某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.