题目内容
如图是Na2O2和CO2定性、定量实验的装置示意图.
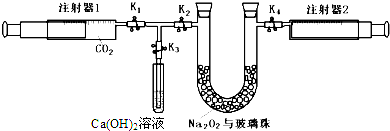
注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5gNa2O2粉末.实验开始时,打开KI、K2、K4止水夹,关闭K3止水夹推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动.回答下列问题:(本题不考虑注射器内壁的磨擦阻力)
(1)U型管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是 .
(2)U型管中可观察到的反应现象是 .
(3)注射器1活塞推到底后,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是 .
(4)为了使剩余气体中二氧化碳能反应完,接下来的操作是 .
(5)要证明反应产物之一为氧气,最为方便的实验方法是 .

注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5gNa2O2粉末.实验开始时,打开KI、K2、K4止水夹,关闭K3止水夹推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动.回答下列问题:(本题不考虑注射器内壁的磨擦阻力)
(1)U型管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是
(2)U型管中可观察到的反应现象是
(3)注射器1活塞推到底后,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是
(4)为了使剩余气体中二氧化碳能反应完,接下来的操作是
(5)要证明反应产物之一为氧气,最为方便的实验方法是
考点:性质实验方案的设计
专题:
分析:(1)U型管内的玻璃珠并不参与反应,所起的作用除防止过氧化钠粉末被吹走外,增大过氧化钠和二氧化碳气体接触面积使之充分反应;
(2)随过氧化钠和二氧化碳的反应生成碳酸钠固体,固体由黄色变化为白色;
(3)依据二氧化碳和过氧化钠反应生成氧气的体积减小一半为50ml,但反应是放热反应,温度升高,气体体积增大;
(4)为了使剩余气体中二氧化碳能反应完,注射器中反复几次推入U形管;
(5)依据氧气特征性质是能使带火星的木条复燃证明;
(6)依据反应生成的固体是碳酸钠,设计实验用盐酸溶解后生成的二氧化碳能使澄清石灰水变浑浊证明.
(2)随过氧化钠和二氧化碳的反应生成碳酸钠固体,固体由黄色变化为白色;
(3)依据二氧化碳和过氧化钠反应生成氧气的体积减小一半为50ml,但反应是放热反应,温度升高,气体体积增大;
(4)为了使剩余气体中二氧化碳能反应完,注射器中反复几次推入U形管;
(5)依据氧气特征性质是能使带火星的木条复燃证明;
(6)依据反应生成的固体是碳酸钠,设计实验用盐酸溶解后生成的二氧化碳能使澄清石灰水变浑浊证明.
解答:
解:(1)U型管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是,增大反应速率,增大过氧化钠和二氧化碳的接触面,使反应完全,
故答案为:增大过氧化钠和二氧化碳的接触面,使反应完全;
(2)U形管中过氧化钠和二氧化碳反应生成碳酸钠,固体颜色逐渐由黄色变化为白色,
故答案为:淡黄色粉末渐渐变白;
(3)注射器I体积为100ml,活塞推到底后,依据反应2Na2O2+2CO2=2Na2CO3+O2,反应后生成的氧气为50ml,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是该反应为放热反应,使反应后气体温度升高,体积变大,
故答案为:该反应为放热反应,使反应后气体温度升高,体积变大;
(4)为了使剩余气体中二氧化碳能反应完,注射器中反复几次推入U形管,将注射器2中气体再推入U型管,反复数次,
故答案为:将注射器2中气体再推入U型管,反复数次;
(5)氧气特征性质是能使带火星的木条复燃证明,打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃,证明生成氧气,
故答案为:打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃.
故答案为:增大过氧化钠和二氧化碳的接触面,使反应完全;
(2)U形管中过氧化钠和二氧化碳反应生成碳酸钠,固体颜色逐渐由黄色变化为白色,
故答案为:淡黄色粉末渐渐变白;
(3)注射器I体积为100ml,活塞推到底后,依据反应2Na2O2+2CO2=2Na2CO3+O2,反应后生成的氧气为50ml,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是该反应为放热反应,使反应后气体温度升高,体积变大,
故答案为:该反应为放热反应,使反应后气体温度升高,体积变大;
(4)为了使剩余气体中二氧化碳能反应完,注射器中反复几次推入U形管,将注射器2中气体再推入U型管,反复数次,
故答案为:将注射器2中气体再推入U型管,反复数次;
(5)氧气特征性质是能使带火星的木条复燃证明,打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃,证明生成氧气,
故答案为:打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃.
点评:本题考查了实验验证物质性质的实验方法和设计,物质性质,气体体积变化,气体验证,实验基本操作和注意问题是关键,题目难度中等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
25℃时,pH=2的酸和pH=12的碱溶液等体积混合后,恢复至原温,溶液呈酸性.其原因可能是( )
| A、生成了一种强酸弱碱盐 |
| B、等浓度的强酸和弱碱溶液反应 |
| C、浓的弱酸溶液和稀的强碱溶液反应 |
| D、浓的强酸和稀的强碱溶液反应 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |
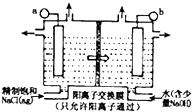 ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.