题目内容
下列变化中,属于放热反应的是( )
| A、H2O(g)═H2O(l)△H=-44kJ/mol |
| B、2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol |
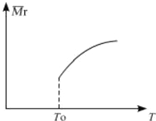
C、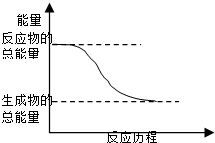 能量变化如图所示的化学反应 |
| D、形成化学键时放出能量的化学反应 |
考点:吸热反应和放热反应
专题:
分析:A.水由气态到液态是物理变化;
B.热化学方程式中吸热为正;
C.放热反应中反应物的总能量大于生成物的总能量;
D.形成化学键必定放出能量的反应可能是吸热反应.
B.热化学方程式中吸热为正;
C.放热反应中反应物的总能量大于生成物的总能量;
D.形成化学键必定放出能量的反应可能是吸热反应.
解答:
解:A.水由气态到液态是放热热的物理变化,故A错误;
B.热化学方程式中吸热为正,故B错误;
C.反应物的总能量大于生成物的总能量必定是放热反应,故C正确;
D.形成化学键必定放出能量,但不一定是放热反应,故D错误.
故选C.
B.热化学方程式中吸热为正,故B错误;
C.反应物的总能量大于生成物的总能量必定是放热反应,故C正确;
D.形成化学键必定放出能量,但不一定是放热反应,故D错误.
故选C.
点评:本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
相关题目
已知X、Y、Z、W四种短周期主族元素在周期表中相对位置如图所示,下列说法不正确的是( )
| X | Y |
| Z | W |
| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径小 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
水是生命之源、生态之基,下列关于水的描述正确的是( )
| A、H216O中,质量数之和是质子数之和的两倍 |
| B、在纯水中加入少量铵盐不会对水的电离产生影响 |
| C、100℃时,纯水的pH=7 |
D、H2O的电子式为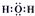 |
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”,下列有关说法中正确的是(( )
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
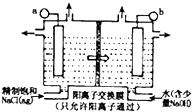 ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.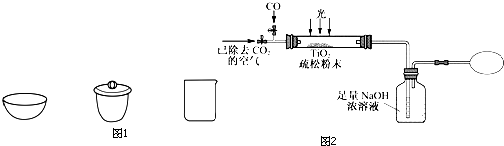
 用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)