题目内容
12.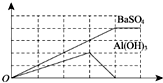 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )| A. | Q为NH4Al(SO4)2,P为Ba(OH)2 | B. | Q为Ba(OH)2,P为明矾 | ||
| C. | Q为明矾,P为Ba(OH)2 | D. | Q为Ba(AlO2)2,P为硫酸铝 |
分析 由图可知,当铝离子完全沉淀时,硫酸根离子部分沉淀,当硫酸根离子完全沉淀时,氢氧化铝沉淀恰好完全溶解,根据反应方程式判断.
解答 解:由图可知,当铝离子完全沉淀时,硫酸根离子部分沉淀,当硫酸根离子完全沉淀时,氢氧化铝沉淀恰好完全溶解,
A.Q为NH4Al(SO4)2,P为Ba(OH)2,当硫酸根离子完全沉淀时,二者反应方程式为:NH4Al(SO4)2+2Ba(OH)2=Al(OH)3↓+2BaSO4↓+NH3•H2O,氢氧化铝沉淀没有溶解,与图象不符,故A错误;
B.Q为Ba(OH)2,P为明矾,向溶液Ba(OH)2中滴加明矾溶液,开始时氢氧根离子生成偏铝酸根离子,不生成氢氧化铝沉淀,所以溶液中只有一种沉淀硫酸钡,不符合题意,故B错误;
C.Q为明矾,P为Ba(OH)2,当硫酸根离子完全沉淀时,二者反应方程式为:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O,氢氧化铝沉淀完全溶解,与图象相符,故C正确;
D.Q为Ba(AlO2)2,P为硫酸铝,向Ba(AlO2)2溶液中滴加硫酸铝溶液,开始时生成硫酸钡沉淀和氢氧化铝沉淀,当硫酸铝过量时,氢氧化铝沉淀不溶解,与图象不符,故D错误.
故选C.
点评 本题考查铝的重要化合物及计算,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
14.下列关于苯的叙述中正确的是( )
| A. | 苯分子的结构中六个碳原子的连接方式是单双建交替组成的环状 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
15.X酯完全燃烧生成CO2和水的物质的量之比为1:1,X经过水解得B和C,C氧化可得到B,则X酯为( )
| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
17.下列元素中,最高正化合价数值最大的是( )
| A. | Si | B. | N | C. | O | D. | Ar |
1.如表是元素周期表的一部分,针对表中元素,填写下列空白.
(1)Al3+的结构示意图为 .
.
(2)CO2中存在的化学键是共价键,CO2的电子式为 .
.
(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 .
.(2)CO2中存在的化学键是共价键,CO2的电子式为
 .
.(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
2.热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol表示( )
| A. | 碳和水反应吸收131.3kJ 能量 | |
| B. | 1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量 | |
| C. | 1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ | |
| D. | 1 个固态碳原子和1 分子水蒸气反应吸热131.1kJ |