题目内容
2.热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol表示( )| A. | 碳和水反应吸收131.3kJ 能量 | |
| B. | 1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量 | |
| C. | 1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ | |
| D. | 1 个固态碳原子和1 分子水蒸气反应吸热131.1kJ |
分析 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol表示1mol固体碳与1mol水蒸气完全反应生成1mol一氧化碳气体和1mol氢气,吸收热量131.3KJ,反应热与反应物生成物聚集状态有关,表述时应说明聚集状态,据此解答.
解答 解:A.在表述热化学方程式时,应表述出物质的状态及物质的量,故A错误;
B.物质的聚集状态影响到物质所具有的能量,在表述热化学方程式时,应表述出物质的状态,故B错误;
C.由热化学方程式可知,1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ,故C正确;
D.热化学方程式中的系数只表示物质的量,不表示分子数,故D错误;
故选C.
点评 本题考查热化学方程式知识,明确热化学方程式的含义是解题关键,注意物质的聚集状态影响到物质所具有的能量,在表述热化学方程式时,应表述出物质的状态,题目难度不大.

练习册系列答案
相关题目
12.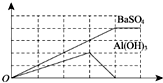 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
 已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )
已知向溶液Q中滴加溶液P可生成两种沉淀,所得沉淀量与所加入的P溶液的体积关系如图所示,则Q、P分别为( )| A. | Q为NH4Al(SO4)2,P为Ba(OH)2 | B. | Q为Ba(OH)2,P为明矾 | ||
| C. | Q为明矾,P为Ba(OH)2 | D. | Q为Ba(AlO2)2,P为硫酸铝 |
13.某饱和一元醛发生银镜反应时可以析出21.6g银,等量的醛完全燃烧可以产生8.96LCO2(标准状况),则该醛为( )
| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |
10.含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是( )
| A. | 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=-114.6kJ/mol | |
| B. | KOH(s)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l);△H=-57.3 kJ/mol | |
| C. | 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=-114.6 kJ/mol | |
| D. | KOH(aq)+$\frac{1}{2}$ H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l);△H=-57.3kJ/mol |
17.下列叙述正确的是( )
| A. | 24Mg32S 晶体中电子总数与中子总数之比为1:1 | |
| B. | CO2和PCl5分子中各原子最外层都满足8 电子结构 | |
| C. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| D. | 元素周期表中第4 列元素形成的化合物数目最多 |
7.下列说法错误的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有总能量的相对大小 | |
| D. | 吸热反应在一定的条件下也能发生 |
14.在铁与铜的混合物中,加入一定量的稀硝酸,微热,充分反应后,剩余金属a g,再向其中加入一定量的稀HCl,微热,充分反应后剩余金属b g( )
| A. | a可能等于b | B. | a一定大于b | C. | a可能大于b | D. | a一定等于b |
11.把铝粉与Fe3O4的混合物,分为两等份.前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应.前后两种情况下生成的气体在同温同压下的体积比是( )
| A. | 1:1 | B. | 3:4 | C. | 9:8 | D. | 4:3 |
12. 原子序数为x的元素在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和如图所示,其中不可能的是(La系、Ac系、0族元素除外)( )
原子序数为x的元素在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和如图所示,其中不可能的是(La系、Ac系、0族元素除外)( )
 原子序数为x的元素在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和如图所示,其中不可能的是(La系、Ac系、0族元素除外)( )
原子序数为x的元素在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和如图所示,其中不可能的是(La系、Ac系、0族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |