题目内容
15. NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.(1)氮氧化物产生的环境问题有产生光化学烟雾或形成酸雨(填一种).
(2)氧化-还原法消除氮氧化物的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
①反应Ⅰ为:NO+O3═NO2+O2,生成11.2L O2(标准状况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,当n(NO2):n[CO(NH2)2]=3:2时,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
①已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
写出NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1.
②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3:1,则NO2的平衡转化率是75%.
③上述反应达平衡后,其它条件不变时,再往容器中同时充入NO2、SO2、SO3、NO各1mol,平衡A(填序号).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
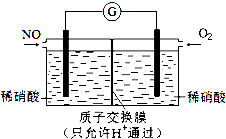
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料.则负极的电极反应式是NO-3e-+2H2O=NO3-+4H+.
分析 (1)根据含氮化合物对环境的影响来回答;
(2)①化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
②反应方程式中,系数之比等于物质的量之比;
(3)①根据盖斯定律结合热化学方程式的书写来回答;
②根据化学平衡中的三行式进行计算;
③根据Qc和K的关系来确定化学平衡的移动方向;
(4)在原电池的负极上发生失电子的氧化反应.
解答 解:(1)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,故答案为:产生光化学烟雾或形成酸雨;
(2)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(3)①已知:A、NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,所以该反应的△H=-196.6kJ•mol-1-2(-41.8kJ•mol-1)=-113.0 kJ•mol-1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1;
②设NO2的变化浓度是x,
NO2(g)+SO2(g)?SO3(g)+NO(g)
初始浓度:0.5 0.5 0 0
变化浓度:x x x x
平衡浓度:0.5-x 0.5-x x x
则$\frac{x}{0.5-x}=\frac{3}{1}$,解得x=0.375,所以二氧化氮的转化率=$\frac{0.375}{0.5}$×100%=75%,
故答案为:75%;
③反应的平衡常数K=$\frac{0.375×0.375}{0.125×0.125}$=9,再往容器中同时充入NO2、SO2、SO3、NO各1mol,即浓度各增加0.5mol/L,此时Qc=$\frac{0.875×0.875}{0.625×0.625}$=1.96<K,所以向正反应方向移动,
故答案为:A;
(4)将NO转化为HNO3的原电池中,负极上发生一氧化氮失电子的氧化反应,即NO-3e-+2H2O=NO3-+4H+,
故答案为:NO-3e-+2H2O=NO3-+4H+.
点评 本题考查学生热化学、电化学以及化学平衡的有关计算知识,是考试的重点和难点,难度中等.

 阅读快车系列答案
阅读快车系列答案| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.(2)原子半径③>④,金属性③>④,(填“>”或“<”)
(3)②和⑦形成的化合物中,能使品红溶液腿色的是SO2(填化学式),它对环境的主要危害是形成酸雨,⑦、⑧元素形成的氢化物热稳定性较强的是HCl(填化学式).
(4)写出③与水反应的化学方程式2Na+2H2O═H2↑+2NaOH.
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目增大 | ||
| C. | 该硫酸铜晶体体积不变 | D. | 溶液的蓝色不变 |
①G→Q+NaCl;
②Q+H2O-→X+H2;
③Y+NaOH→G+Q+H2O;④Z+NaOH→X+Q+H2O.
请根据该小组的探究结果,对这五种氯的化合物按氯元素化合价由低到高的顺序排列正确的是( )
| A. | GQXYZ | B. | XYGQZ | C. | GYQZX | D. | GXQYZ |

| A. | 正极反应为Cl2+2e-=2Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
(甲) 2mol SO2和1mol O2;
(乙) 1mol SO2和0.5mol O2;
(丙) 2mol SO3;
恒温、恒容下反应达平衡时,下列关系一定正确的是( )
| A. | c(SO2)与c(O2)之比k:k甲=k丙>k乙 | |
| B. | SO3的质量m:m甲=m丙>2m乙 | |
| C. | 容器内压强P:P甲=P丙>2P乙 | |
| D. | 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是CO2.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的单质和石灰乳作用可制取漂白粉,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)元素④的原子最外层电子数为7.
(6)元素⑦的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(7)元素⑧、⑨中,化学性质较不活泼的元素是S(填元素符号),氢化物较稳定的是HCl(填化学式).
(8)元素②的氢化物化学式NH3,元素⑨的最高价氧化物的水化物的化学式HClO4
(9)元素⑤的氢氧化物和稀盐酸反应的化学方程式NaOH+HCl=NaCl+H2O.
| A. | 酒精灯不慎打翻着火用水浇灭 | |
| B. | 直接将浓硫酸倒入盛有水的烧杯中进行稀释 | |
| C. | 固体药品可用镊子或钥匙取用 | |
| D. | 蒸馏操作烧瓶可以直接用酒精灯加热 |
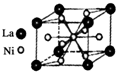 目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.
目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.