题目内容
12.在100℃时,将0.40mol 的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n (N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 从反应开始到20s时,NO2的平均反应速率为0.15 mol•L-1min-1 | |
| B. | 达平衡后,混合气体的平均摩尔质量为69g/mol | |
| C. | 达平衡后,若升高温度器气体颜色变深,则可推知升高温度后反应平衡常数K减小 | |
| D. | 达平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,则平衡将向左移动 |
分析 A.从反应开始到20s时,△n (NO2)=0.05mol×2=0.1mol,结合v=$\frac{△c}{△t}$计算;
B.由质量守恒可知,m始终为0.40mol×46g/mol=18.4g,平衡时总物质的量为0.08mol+(0.4mol-0.08mol×2)=0.32mol,结合M=$\frac{m}{n}$计算;
C.升高温度器气体颜色变深,则2NO2?N2O4逆向移动,正反应为放热反应;
D.平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,压强减小.
解答 解:A.从反应开始到20s时,△n (NO2)=0.05mol×2=0.1mol,NO2的平均反应速率为$\frac{\frac{0.1mol}{2L}}{20s}$=0.0025mol/(L.s)=0.15 mol•L-1min-1,故A正确;
B.由质量守恒可知,m始终为0.40mol×46g/mol=18.4g,平衡时总物质的量为0.08mol+(0.4mol-0.08mol×2)=0.32mol,混合气体的平均摩尔质量为$\frac{18.4g}{3.2mol}$=57.5g/mol,故B错误;
C.升高温度器气体颜色变深,则2NO2?N2O4逆向移动,正反应为放热反应,则升高温度后反应平衡常数K减小,故C正确;
D.平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,压强减小,该反应为气体体积减小的反应,则平衡向左移动,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡移动、速率计算为解答的关键,侧重分析与计算能力的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
8.化学与人类生活、气候变化、环境质量等密切相关.下列说法不正确的是( )
| A. | 淘汰和禁止黄标车(高污染排放车辆)上路行驶,可减少雾霾天气 | |
| B. | 煤的干馏、液化和气化均为化学变化 | |
| C. | 可利用乙醇、次氯酸钠等消毒剂的氧化杀菌作用防控病毒 | |
| D. | 开发和利用新能源代替化石燃料,符合中国在世界环境日的主题--“践行绿色生活” |
9.常温下,在指定溶液中下列各组离子一定能大最共存的是( )
| A. | 加入Al能放出H2的溶液:K+、Cu2+、NO3-、SO42- | |
| B. | 某无色透明溶液:Fe2+、ClO-、SiO32-、Na + | |
| C. | 加入(NH4)2CO3后加热,有气体产生的溶液:Na+、K+、NO3-、Cl- | |
| D. | 0.1mol/LNaHCO3溶液:Na+、A13+、SO42-、NO3- |
6.香叶醛(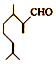 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( ) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
) 下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水发生加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
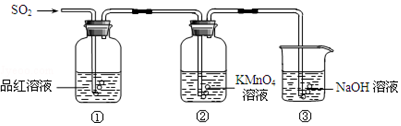
7.某兴趣学习小组的同学就用如图5个装置进行常见物质的制取,并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题:
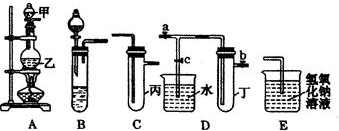
(1)将A、C、E相连后,以二氧化锰和浓盐酸(填写名称)为原料制取Cl2,仪器乙的名称是圆底烧瓶.
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
实验Ⅰ获得结论不合理请说明理由:没有事先证明干燥的氯气无漂白性
实验Ⅱ获得结论是否合理?不合理(填“合理”或“不合理”).请写出产生气泡的离子方程式HCO3-+H+=CO2↑+H2O
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱.若C中加入硫酸钾溶液,则C中预期出现的现象是产生淡黄色沉淀.
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2.一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先关闭a、b,打开c再双手紧握(或微热)试管丁,使NO2逸出与水接触以使烧杯中的水进入试管丁,观察现象,E装置的作用是吸收尾气防止污染空气.

(1)将A、C、E相连后,以二氧化锰和浓盐酸(填写名称)为原料制取Cl2,仪器乙的名称是圆底烧瓶.
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅱ获得结论是否合理?不合理(填“合理”或“不合理”).请写出产生气泡的离子方程式HCO3-+H+=CO2↑+H2O
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱.若C中加入硫酸钾溶液,则C中预期出现的现象是产生淡黄色沉淀.
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2.一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先关闭a、b,打开c再双手紧握(或微热)试管丁,使NO2逸出与水接触以使烧杯中的水进入试管丁,观察现象,E装置的作用是吸收尾气防止污染空气.
17.常温下,下列有关电解质溶液的叙述正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | pH=2的盐酸与pH=12的氨水等体积混合后所得溶液pH=7 | |
| C. | pH为a的CH3COOH溶液和pH为b的NaOH溶液混合后溶液显酸性,则a一定大于b | |
| D. | 将10mLpH=a的盐酸与100 mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |