题目内容
8.化学与人类生活、气候变化、环境质量等密切相关.下列说法不正确的是( )| A. | 淘汰和禁止黄标车(高污染排放车辆)上路行驶,可减少雾霾天气 | |
| B. | 煤的干馏、液化和气化均为化学变化 | |
| C. | 可利用乙醇、次氯酸钠等消毒剂的氧化杀菌作用防控病毒 | |
| D. | 开发和利用新能源代替化石燃料,符合中国在世界环境日的主题--“践行绿色生活” |
分析 A.减少汽车污染,可减少雾霾;
B.煤在隔绝空气下发生复杂的物理化学变化,煤的气化生成CO和氢气、煤的液化生成甲醇;
C.乙醇不具有氧化性;
D.开发和利用新能源代替化石燃料,可减少环境污染.
解答 解:A.减少汽车污染,可减少颗粒污染,减少雾霾,故A正确;
B.煤的气化生成CO和氢气、煤的液化生成甲醇和煤的干馏(煤在隔绝空气下发生复杂的物理化学变化),均为化学变化,故B正确;
C.乙醇不具有氧化性,故C错误;
D.开发和利用新能源代替化石燃料,可减少酸雨等环境污染,故D正确.
故选C.
点评 本题考查较为综合,涉及环保等知识,为高考常见题型和高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 6.2g白磷中所含P-P键的数目为0.15NA | |
| B. | 含H2O2 3.4克的溶液完全分解,其电子转移数目为NA | |
| C. | 117g氯化钠固体含有2NA个氯化钠分子 | |
| D. | 6克金刚石含NA个C-C键 |
19.根据题意回答下列问题:
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0,5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c=4.18×10-3kJ•g-1•℃-1,则该反应的中和热为△H=-55.7 kJ•mol-1.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏大(填“偏大”、“偏小”或“不变”).
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0,5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏大(填“偏大”、“偏小”或“不变”).
3.下列说法不正确的是( )
| A. | 乙醇和丁烷都存在同分异构体 | |
| B. | (CH3CH2)2CHCH3的系统命名是2-乙基丁烷 | |
| C. | 氧气和臭氧互为同素异形体 | |
| D. | 甲烷与异戊烷互为同系物 |
13.2016年世界环境日我国确定的主题是“改善环境质量,推动绿色发展”.下列做法不应该提倡的是( )
| A. | 发展清洁能源 | B. | 增加植被面积 | C. | 燃烧煤炭供热 | D. | 选择绿色出行 |
17.下列表示不正确的是( )
| A. | HCl的电子式 | B. | SiO2的结构式O=Si=O | ||
| C. | S的原子结构示意图  | D. | 乙炔的分子式C2H2 |
12.在100℃时,将0.40mol 的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
以下说法不正确的是( )
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n (N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 从反应开始到20s时,NO2的平均反应速率为0.15 mol•L-1min-1 | |
| B. | 达平衡后,混合气体的平均摩尔质量为69g/mol | |
| C. | 达平衡后,若升高温度器气体颜色变深,则可推知升高温度后反应平衡常数K减小 | |
| D. | 达平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,则平衡将向左移动 |
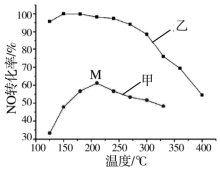 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0