题目内容
1.实验室常用二氧化锰和浓盐酸共热的方法制取氯气.根据要求回答下列问题.
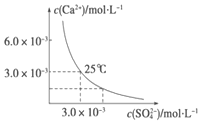
(1)A、B、C三套装置中,应选用的装置是B(选填“A”、“B”、“C”);
(2)写出实验室制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O ;
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式Cl2+2NaOH=NaCl+NaClO+H2O .
分析 (1)用二氧化锰和浓盐酸共热的方法制取氯气,氯气比空气重,用向上排气法收集;
(2)二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2;
(3)氯气是有毒的污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水.
解答 解:(1)用二氧化锰和浓盐酸共热的方法制取氯气,氯气比空气重,用向上排气法收集,装置A无加热装置,B符合制备装置,C中氯气会从长颈漏斗中跑出,
故答案为:B;
(2)二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2,反应的化学方程式为:
MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)氯气是有毒的污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液;2NaOH+Cl2═NaCl+NaClO+H2O.
点评 本题考查了实验室制备氯气的方法和原理分析判断,主要是装置选择和反应化学方程式书写,掌握基础是关键,题目难度不大.

练习册系列答案
相关题目
17.下列表示不正确的是( )
| A. | HCl的电子式 | B. | SiO2的结构式O=Si=O | ||
| C. | S的原子结构示意图  | D. | 乙炔的分子式C2H2 |
12.在100℃时,将0.40mol 的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
以下说法不正确的是( )
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n (N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 从反应开始到20s时,NO2的平均反应速率为0.15 mol•L-1min-1 | |
| B. | 达平衡后,混合气体的平均摩尔质量为69g/mol | |
| C. | 达平衡后,若升高温度器气体颜色变深,则可推知升高温度后反应平衡常数K减小 | |
| D. | 达平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,则平衡将向左移动 |
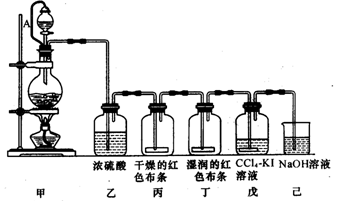
9. 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )| A. | 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 | |
| B. | 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| C. | 溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| D. | 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
6.已知常温下,KSP(AgCl)=1.8×10-10 mol2•L-2,KSP(AgI)=8.3×10-17mol2•L-2,下列叙述中,正确的是( )
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) | |
| D. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
11.化学材料在生活中应用广泛.下列材料制成的物品难降解的是( )
| A. | 木材造的纸张 | B. | 聚氯乙烯制的电话卡 | ||
| C. | 淀粉做的地膜 | D. | 蚕丝织的锦缎 |

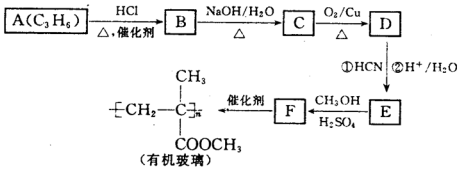
 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$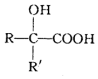 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子) )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线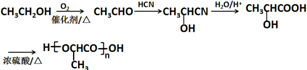 .合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
.合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.