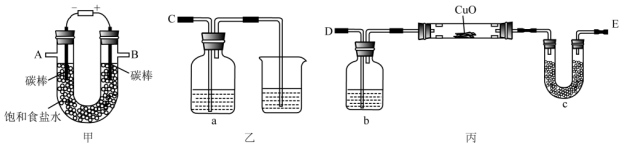
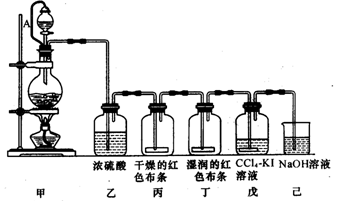
题目内容
4.在100℃时,某有机物蒸汽20mL与60mL氧气混合,点燃后恰好完全反应,生成CO2与水蒸气体积为1:1.5,若将混合气体通过盛浓硫酸的洗气瓶后,气体变为40mL,有机物的分子式为C2H6O.分析 有机物完全燃烧生成CO2与水蒸气体积为1:1.5,则该有机物中C、H原子数目之比为1:3,通过盛浓硫酸的洗气瓶后,剩余40ml为CO2,则有机物分子含有2个C原子、6个H原子,再根据氧原子守恒确定该有机物中O原子数目.
解答 解:有机物完全燃烧生成CO2与水蒸气体积为1:1.5,则该有机物中C、H原子数目之比为1:3,通过盛浓硫酸的洗气瓶后,剩余40ml为CO2,则有机物分子含有2个C原子、6个H原子,生成水的体积为:40mL×1.5=60mL,有机物、氧气、二氧化碳、水的物质的量之比=20:60:40:60=1:3:2:3,根据O原子守恒可知有机物中O原子数目为:$\frac{2×2+1×3-2×3}{1}$=1,
所以该有机物分子式为:C2H6O,
故答案为:C2H6O.
点评 本题考查了有机物分子式确定的计算,题目难度不大,注意掌握守恒思想在确定有机物分子式中的应用方法,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
1.香叶醛( 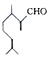 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( 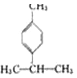 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(  ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水反应加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
12.在100℃时,将0.40mol 的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
以下说法不正确的是( )
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n (N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 从反应开始到20s时,NO2的平均反应速率为0.15 mol•L-1min-1 | |
| B. | 达平衡后,混合气体的平均摩尔质量为69g/mol | |
| C. | 达平衡后,若升高温度器气体颜色变深,则可推知升高温度后反应平衡常数K减小 | |
| D. | 达平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,则平衡将向左移动 |
19.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)+92.4kJ. 实验测得起始、平衡时的有关数据如表:
下列叙述正确的是( )
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 反应的平衡常数:③>①>② | |
| B. | 达到平衡时氨气的体积分数:①>③ | |
| C. | 放出的热量(kJ):a<b<92.4 | |
| D. | 反应得到1mol NH3(l),放出热量46.2kJ |
9.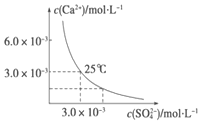 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )| A. | 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 | |
| B. | 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| C. | 溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| D. | 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,含NA个分子的H2、CO混合气体的体积约为22.4L | |
| B. | 56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定是3NA | |
| C. | 28g乙烯与C3H8的混合物中含有C-H键的数目为4NA | |
| D. | 常温下,pH=11的NaOH溶液中由水电离出的H+数目为0.001NA |
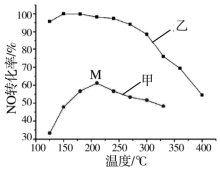 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0