题目内容
12.下列物质的电子式书写正确的是( )①Ca(OH)2
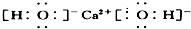
②H2S
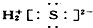
③OH-

④Al3+Al3+
⑤N2
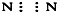
⑥CO2

⑦HClO
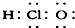
⑧Na2O2
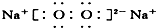
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
分析 ①Ca(OH)2为离子化合物; ②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键; ③OH-为带1个负电荷的阴离子;④Al3+,金属阳离子符号即为其电子式; ⑤N2 中N原子满足8个电子的稳定结构;⑥CO2 中C分别为O形成2对共价键;⑦HClO,HClO分子中存在H-O和O-Cl两个共价键;⑧Na2O2是钠离子和过氧根离子构成的离子化合物,据此解答即可.
解答 解:①Ca(OH)2 为离子化合物,电子式为:
 ,故正确;
,故正确;
②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故错误;
,故错误;
③氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为: ,故错误;
,故错误;
④Al3+,金属阳离子符号即为其电子式,故正确;
⑤N2中N原子满足8个电子的稳定结构,电子式为: ,故错误;
,故错误;
⑥CO2 中C分别为O形成2对共价键;⑦HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ,故错误;
,故错误;
⑧Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为: ,故正确,故正确的是:①④⑧,故选D.
,故正确,故正确的是:①④⑧,故选D.
点评 本题主要考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.关于氢键,下列说法正确的是( )
| A. | 每一个水分子内含有两个氢键 | |
| B. | 氢键只能存在于分子之间 | |
| C. | DNA中的碱基互补配对是通过氢键来实现的 | |
| D. | HF是一种非常稳定的化合物,这是由氢键所致 |
3.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述正确的是( )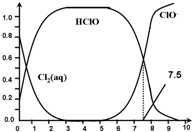
Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示.下列表述正确的是( )

| A. | Cl2(g)+H2O?2H++ClO-+Cl- K=10-12.1 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好 | |
| D. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
20.常温下,将pH=5的硫酸溶液稀释500倍,c(SO42-)和c(H+)之比约为( )
| A. | 1:1 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
4.X、Y、Z均为短周期主族元素,X为地壳中含量最高的金属元素,Y的L层电子数等于K层电子数的3倍,Z元素M层电子数为7,下列有关说法不正确的是( )
| A. | X与Y形成的化合物既能与盐酸反应也能与氢氧化钠反应 | |
| B. | X的原子半径大于Z的原子半径 | |
| C. | X与Z形成的化合物的水溶液中逐滴滴加氨水至过量,先产生白色沉淀后沉淀溶解 | |
| D. | Z的最高价氧化物对应的水化物为强酸 |


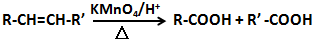
 .
. .
.