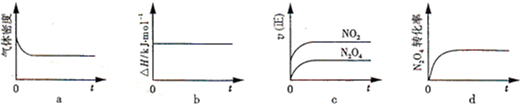
题目内容
19.某同学设计工业上冶炼铝的工艺流程如下(注:铝土矿中含有SiO2、Fe2O3等杂质)
(1)物质A经提纯结晶之后可以得到小苏打,Y的结构式为0=C=0.
(2)反应Ⅱ中得到沉淀B的离子方程式有CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-、2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-.
(3)OH-、AlO${\;}_{2}^{-}$、SiO${\;}_{3}^{2-}$结合质子(H+)的能力由强到弱的顺序是OH->AlO2->SiO32-.
(4)反应Ⅰ、Ⅱ、Ⅲ、Ⅳ中有一个与其他三个反应类型不同,写出相应的化学方程式2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑.
分析 电解物质B得到Al,物质B为氧化铝,沉淀B系列转化后加热得到氧化铝,则沉淀B中含有氢氧化铝,溶液乙加入过量的Y得到氢氧化铝沉淀,分离得到物质A经提纯结晶之后可以得到小苏打,则Y为二氧化碳,可知试剂X为NaOH,沉淀A为氧化铁,溶液乙中含有硅酸钠、偏铝酸钠,沉淀B为氢氧化铝、硅酸,用酸溶液溶解,过滤除去硅酸,滤液中加入弱碱得到氢氧化铝.
解答 解:电解物质B得到Al,物质B为氧化铝,沉淀B系列转化后加热得到氧化铝,则沉淀B中含有氢氧化铝,溶液乙加入过量的Y得到氢氧化铝沉淀,分离得到物质A经提纯结晶之后可以得到小苏打,则Y为二氧化碳,可知试剂X为NaOH,沉淀A为氧化铁,溶液乙中含有硅酸钠、偏铝酸钠,沉淀B为氢氧化铝、硅酸,用酸溶液溶解,过滤除去硅酸,滤液中加入弱碱得到氢氧化铝.
(1)Y为二氧化碳,结构式为O=C=O,故答案为:O=C=O;
(2)反应Ⅱ中得到沉淀B的离子方程式有:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;
(3)结合质子能力越强,相应的酸电离出氢离子的能力就越弱,其对应的酸的酸性就越弱,酸性强弱H2SiO3>Al(OH)3,结合质子能力:AlO2->SiO32-,氢氧化钠与氢氧化铝、硅酸反应生成盐与水,所以结合质子能力:OH->AlO2->SiO32-,
故答案为:OH->AlO2->SiO32-;
(4)反应Ⅰ、Ⅱ、Ⅲ均属于非氧化还原反应,反应Ⅳ属于氧化还原反应,反应IV的化学方程式为:2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查物质制备工艺流程,关键是理解工艺流程原理,熟练掌握元素化合物性质,有利于学生分析和解决问题的能力的培养.

 快捷英语周周练系列答案
快捷英语周周练系列答案| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、托盘天平、胶头滴管、1000 mL容量瓶.(在横线上填写所缺仪器的名称)需要高锰酸钾0.004mol
(3)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.024 mol/L.
①Ca(OH)2
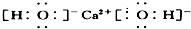
②H2S
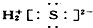
③OH-

④Al3+Al3+
⑤N2
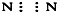
⑥CO2

⑦HClO
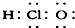
⑧Na2O2
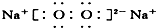
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与少量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向浓硝酸中加入铜片,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 二氧化硫通入次氯酸钙溶液:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
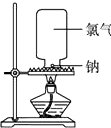 下面是钠和氯气反应的实验设计:
下面是钠和氯气反应的实验设计: