题目内容
4.X、Y、Z均为短周期主族元素,X为地壳中含量最高的金属元素,Y的L层电子数等于K层电子数的3倍,Z元素M层电子数为7,下列有关说法不正确的是( )| A. | X与Y形成的化合物既能与盐酸反应也能与氢氧化钠反应 | |
| B. | X的原子半径大于Z的原子半径 | |
| C. | X与Z形成的化合物的水溶液中逐滴滴加氨水至过量,先产生白色沉淀后沉淀溶解 | |
| D. | Z的最高价氧化物对应的水化物为强酸 |
分析 X为地壳中含量最高的金属元素,应为Al,Y的L层电子数等于K层电子数的3倍,为O元素,Z元素M层电子数为7,为Cl元素,结合对应单质、化合物的性质以及元素周期率的递变规律解答该题.
解答 解:X为地壳中含量最高的金属元素,应为Al,Y的L层电子数等于K层电子数的3倍,为O元素,Z元素M层电子数为7,为Cl元素,
A.X与Y形成的化合物为氧化铝,为两性氧化物,既能与盐酸反应也能与氢氧化钠反应,故A正确;
B.同周期元素从左到右原子半径逐渐减小,故B正确;
C.氯化铝与氨水反应只生成氢氧化铝,氢氧化铝只溶解于强碱,故C错误;
D.Cl的非金属性较强,对应的最高价氧化物是酸性最强的含氧酸,故D正确.
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生分析推理能力,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
相关题目
14.已知PbCl2是微溶化合物,溶于水存在下列平衡:PbCl2(s)?Pb2+(aq)+2Cl-(aq),Ksp=1.7×10-5,在0.1 mol/L的AlCl3溶液中加入PbCl2固体,Pb2+的物质的量浓度最大可达到 ( )
| A. | 1.7×10-3 mol/L | B. | 1.9×10-4mol/L | C. | 1.7×10-4mol/L | D. | 5.7×10-5mol/L. |
15.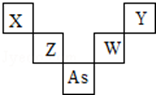 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A. | W的氧化物对应的水化物必是强酸 | |
| B. | X的原子半径比As原子半径小,两者原子序数之差为29 | |
| C. | Z的氧化物可与Y的氢化物水溶液不会发生化学反应 | |
| D. | 图中五种元素均是非金属元素,并且Y的非金属性最强 |
12.下列物质的电子式书写正确的是( )
①Ca(OH)2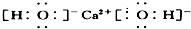
②H2S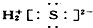
③OH-
④Al3+Al3+
⑤N2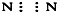
⑥CO2
⑦HClO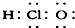
⑧Na2O2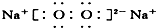
①Ca(OH)2
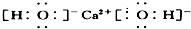
②H2S
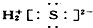
③OH-

④Al3+Al3+
⑤N2
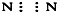
⑥CO2

⑦HClO
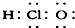
⑧Na2O2
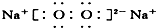
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
15.下列离子方程式书写正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与少量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向浓硝酸中加入铜片,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 二氧化硫通入次氯酸钙溶液:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
11.在室温下等体积的酸和碱的溶液,混合后PH一定等于7的是( )
| A. | PH=3的盐酸和PH=11的氨水 | B. | PH=3的硝酸和PH=11的Ba(OH)2溶液 | ||
| C. | PH=3的硫酸和PH=11的氨水 | D. | PH=3的醋酸和PH=11的Ba(OH)2溶液 |
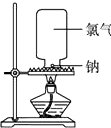 下面是钠和氯气反应的实验设计:
下面是钠和氯气反应的实验设计: