题目内容
7.在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.基态Ni原子的外围电子排布式为1S22S22P63S23P63d84s2,该元素位于元素周期表中的第Ⅷ族.
分析 Ni是28号元素,其原子核外有28个电子,根据构造原理写出基态Ni原子核外电子排布式,由此分析解答.
解答 解:Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2,位于第四周期,第Ⅷ族,故答案为:1S22S22P63S23P63d84s2;Ⅷ.
点评 本题考查原子核外电子排布和周期表的位置知识点,为高频考点,侧重考查学生知识运用能力及空间想象能力,易错点是价层电子对个数的计算方法,题目难度中等.

练习册系列答案
相关题目
17.已知甲醛(HCHO)分子中的4个原子共处于同一平面上.下列分子中所有原子不可能同时共存于同一平面上的是( )
| A. | 苯乙烯 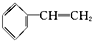 | B. | 苯甲醛 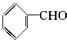 | C. | 苯乙酮 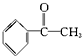 | D. | 苯酚 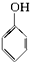 |
18.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中反应 | ||
| C. | 二氧化硫通入石灰水 | D. | 硫在氧气中燃烧 |
15.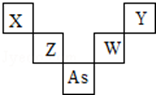 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A. | W的氧化物对应的水化物必是强酸 | |
| B. | X的原子半径比As原子半径小,两者原子序数之差为29 | |
| C. | Z的氧化物可与Y的氢化物水溶液不会发生化学反应 | |
| D. | 图中五种元素均是非金属元素,并且Y的非金属性最强 |
2.下列叙述,错误的是( )
| A. | 从上至下,卤素单质的密度依次增大,碱金属单质的密度也依次增大 | |
| B. | 从上至下,卤素单质的沸点逐渐升高,碱金属单质的熔点逐渐降低 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2不能从NaCl溶液中置换出Cl2 |
12.下列物质的电子式书写正确的是( )
①Ca(OH)2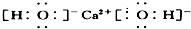
②H2S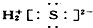
③OH-
④Al3+Al3+
⑤N2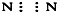
⑥CO2
⑦HClO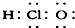
⑧Na2O2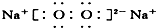
①Ca(OH)2
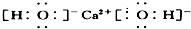
②H2S
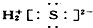
③OH-

④Al3+Al3+
⑤N2
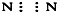
⑥CO2

⑦HClO
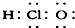
⑧Na2O2
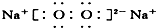
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
15.下列离子方程式书写正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与少量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向浓硝酸中加入铜片,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 二氧化硫通入次氯酸钙溶液:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
14.下列说法中正确的是( )
| A. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 同一原子中,1s、2s、3s所能容纳的电子数越来越多 |