题目内容
3.下列化学用语书写正确的是( )| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硝基苯的结构简式: | |
| C. | (CH3 CH2)2 CHCH2CH3 的名称:2-乙基丁烷 | |
| D. | 甲基的电子式为: |
分析 A.乙烯分子中含有碳碳双键,其结构简式中没有标出官能团结构;
B.硝基中N原子与苯环的C相连;
C.烷烃的命名中出现2-乙基,说明选取的主链错误;
D.甲基为中性原子团,碳原子最外层含有7个电子.
解答 解:A.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故A错误;
B.硝基苯中,硝基的N原子与苯环相连,硝基苯正确的结构简式为: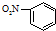 ,故B错误;
,故B错误;
C.(CH3 CH2)2CHCH2CH3 的最长碳链含有5个C,主链为戊烷,其正确名称为:3-乙基戊烷,故C错误;
D.甲基中含有3个C-H键,碳原子最外层含有7个电子,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、有机物命名等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
11.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100 nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴,溴元素又称“海洋元素” |
18.缓冲溶液可以抗御少量酸碱对溶液pH的影响.人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定.己知在人体正常体温时,反应H2CO3?HCO3-+H+的Ka=10-6.1mol•L-1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3.则下列判断正确的是( )
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
8.在常温、常压下,将10mL某气态烃与80mL氧气(过量)的混合物点燃燃烧,当恢复到原来的状况时,测得气体的体积为60mL,则该气态烃的化学式可能是( )
| A. | C3H8 | B. | C8H16 | C. | C8H8 | D. | C3H4 |
15.下列化学用语中,正确的是( )
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |