题目内容
 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应II:CO(g)+2H2(g)?CH3OH(g)△H2
①反应I的平衡常数表达式为K=
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
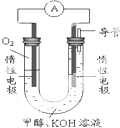
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池中OH-向
②该电池负极的电极反应为
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体.则原CuSO4溶液的物质的量浓度为
考点:化学平衡的计算,热化学方程式,化学电源新型电池,电解原理
专题:基本概念与基本理论
分析:(1)①依据化学方程式和平衡常数概念书写,平衡常数K=
;
②分析图表数据,平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应,反应前后气体体积减小是熵减小的反应;
③依据化学平衡三段式列式计算,转化率=
×100%;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①原电池中阳离子向正极移动、阴离子向负极移动;
②该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-;
③加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
=0.1mol,相当于加入0.1molCuO和0.1molH2O,根据Cu原子守恒计算硫酸铜的物质的量浓度,根据O原子守恒、H原子守恒计算生成气体体积.
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
②分析图表数据,平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应,反应前后气体体积减小是熵减小的反应;
③依据化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①原电池中阳离子向正极移动、阴离子向负极移动;
②该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-;
③加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
| 9.8g |
| 98g/mol |
解答:
(1)①反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应的平衡常数K=
;
故答案为:
;
②图表数据,平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应,△H2<0;反应前后气体体积减小是熵减小的反应,△S<0;
故答案为:<,<;
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,物质的量=0.2mol?L-1 ×2L=0.4mol;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
则CO的转化率=
×100%=80%;
故答案为:80%;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
依据盖斯定律计算,由盖斯定律,①-②+③×4得:
2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l),故△H=-1275.6kJ∕mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4=-885.6 kJ∕mol,
所以其热化学反应方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
故答案为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(3)①原电池中阳离子向正极移动、阴离子向负极移动,所以氢氧根离子向负极移动,故答案为:负;
②该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
③加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
=0.1mol,相当于加入0.1molCuO和0.1molH2O,根据Cu原子守恒得n(CuSO4)=n[Cu(OH)2]=0.1mol,则C(CuSO4)=
=0.2mol/L,
故答案为:0.2mol/L;
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
故答案为:
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
②图表数据,平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应,△H2<0;反应前后气体体积减小是熵减小的反应,△S<0;
故答案为:<,<;
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,物质的量=0.2mol?L-1 ×2L=0.4mol;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
则CO的转化率=
| 1.6mol |
| 2mol |
故答案为:80%;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
依据盖斯定律计算,由盖斯定律,①-②+③×4得:
2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l),故△H=-1275.6kJ∕mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4=-885.6 kJ∕mol,
所以其热化学反应方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
故答案为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(3)①原电池中阳离子向正极移动、阴离子向负极移动,所以氢氧根离子向负极移动,故答案为:负;
②该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
③加入9.8g Cu(OH)2固体能使电解质溶液恢复原状,n[Cu(OH)2]=
| 9.8g |
| 98g/mol |
| 0.1mol |
| 0.5L |
故答案为:0.2mol/L;
点评:本题考查化学平衡常数概念计算,化学平衡计算方法,热化学方程式和盖斯定律计算应用,原电池和电解池原理,侧重考查学生分析问题及计算能力,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列变化不能用勒夏特列原理解释的是( )
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
检验试样中某离子的操作及结论合理的是( )
| A、先加BaCl2溶液有白色沉淀,再加稀HNO3溶液不溶解,则试样中一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则试样中一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则试样中一定有钾元素、没有钠元素 |
下列说法中,正确的是( )
| A、两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B、溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先沉淀 |
| C、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| D、凡是能自发进行的化学反应,一定是△H<0、△S>0 |
 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
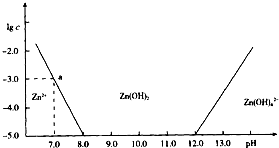 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
