题目内容
关于NaHCO3性质的有关叙述正确的是( )
| A、只能与酸反应 |
| B、医疗上可用于治疗胃酸过多 |
| C、与足量的酸反应时放出的CO2比与等质量的Na2CO3要少 |
| D、同温度时,NaHCO3的溶解度>Na2CO3溶解度 |
考点:钠的重要化合物
专题:
分析:碳酸氢钠不稳定,加热易分解,可与酸反应生成二氧化碳,可与碱反应生成碳酸盐,以此解答该题.
解答:
解:A.NaHCO3可与酸反应生成二氧化碳气体,如与盐酸反应生成二氧化碳、氯化钠和水,也可与碱反应,如与氢氧化钠反应生成碳酸钠和水,故A错误;
B.碳酸氢钠和盐酸反应,可用于中和胃酸,故B正确;
C.等质量的碳酸钠、碳酸氢钠,n(NaHCO3)>n(Na2CO3),分别与足量的盐酸反应,NaHCO3生成的二氧化碳多,故C错误;
D.常温下相同的溶剂时,Na2CO3较NaHCO3易溶,故D错误.
故选B.
B.碳酸氢钠和盐酸反应,可用于中和胃酸,故B正确;
C.等质量的碳酸钠、碳酸氢钠,n(NaHCO3)>n(Na2CO3),分别与足量的盐酸反应,NaHCO3生成的二氧化碳多,故C错误;
D.常温下相同的溶剂时,Na2CO3较NaHCO3易溶,故D错误.
故选B.
点评:本题考查Na2CO3和NaHCO3性质的异同,注意相同条件下,可溶性碳酸盐的溶解度大于相应的碳酸氢盐,为易错点,注意把握Na2CO3和NaHCO3性质,题目难度不大.

练习册系列答案
相关题目
下列变化中,需要加入氧化剂的是( )
| A、HCl→H2 |
| B、HCl→FeCl2 |
| C、H2SO4(浓)→SO2 |
| D、Fe→Fe2O3 |
下列各组中两个变化所发生的反应,属于同一类型的是( )
①由甲苯制甲基环己烷、由乙稀制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由苯制硝基苯、由苯制苯磺酸.
①由甲苯制甲基环己烷、由乙稀制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由苯制硝基苯、由苯制苯磺酸.
| A、只有②③ | B、只有①② |
| C、只有①③ | D、①②③ |
室温下,某溶液中由水电离出的c(OH-)=10-5 mol?L-1,则其溶质可能是( )
| A、CH3COOH |
| B、H2SO4 |
| C、NaOH |
| D、Na2CO3 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的c(OH-)=0.1mol?L-1.下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |
下列离子方程式或化学方程式正确的是( )
| A、SO2气体缓慢通入Na2O2粉末中:2Na2O2+2SO2=2Na2SO3+O2 |
| B、Fe(NO3)2浓溶液中通入HCl气体:Fe2++2H++NO3-=Fe3++NO2↑+H2O |
| C、碳酸镁溶于硝酸中:CO32-+2H+=CO2↑+H2O |
| D、Mg(HCO3)2溶液中加入过量的苛性钾溶液:Mg2++HCO3-+3OH-=Mg(OH)2+CO32-+H2O |
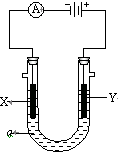 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 下表是元素周期表前三周期的一部分,按要求作答:
下表是元素周期表前三周期的一部分,按要求作答:
