题目内容
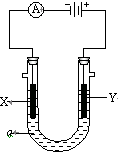 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为
②Y电极上的电极反应式为
③该反应的总反应是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电解饱和食盐水时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子,以此解答该题.
解答:
解:①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气可用淀粉碘化钾试纸检验,可使试纸变蓝色,
故答案为:2Cl--2e-=Cl2↑; 淀粉碘化钾试纸;
③电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑.
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气可用淀粉碘化钾试纸检验,可使试纸变蓝色,
故答案为:2Cl--2e-=Cl2↑; 淀粉碘化钾试纸;
③电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
点评:本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
相关题目
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
| B、NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)>c(HRO3-)+c(RO32-) |
| C、常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| D、常温下,将0.1mol?L-1NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
| A、氨水的电离作用大于氯化铵的水解作用 |
| B、氯化铵的水解作用大于氨水的电离作用 |
| C、氨水的存在抑制了氯化铵的水解 |
| D、氯化铵的存在抑制了氨水的电离 |
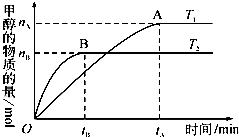 以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )
以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )| A、若保持恒温,当容器中n(CH3OH):n(H2O)为1:1时,该反应已达平衡状态 |
| B、若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态 |
| C、若其他条件不变,实验结果如图所示,则平衡常数:K(T1)<K(T2) |
| D、保持温度不变,当反应已达平衡时,若向容器中再充入1 mol CO2和3 mol H2,当达到新平衡时,n(CH3OH):n(H2)将升高 |
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A、空气、天然气、苛性钾、石灰石 |
| B、液态氯化氢、稀硫酸、硫酸钠晶体、二氧化硫 |
| C、盐酸、水煤气、醋酸、干冰 |
| D、纯碱、铝合金、冰水混合物、乙醇 |
关于NaHCO3性质的有关叙述正确的是( )
| A、只能与酸反应 |
| B、医疗上可用于治疗胃酸过多 |
| C、与足量的酸反应时放出的CO2比与等质量的Na2CO3要少 |
| D、同温度时,NaHCO3的溶解度>Na2CO3溶解度 |