题目内容
下列离子方程式或化学方程式正确的是( )
| A、SO2气体缓慢通入Na2O2粉末中:2Na2O2+2SO2=2Na2SO3+O2 |
| B、Fe(NO3)2浓溶液中通入HCl气体:Fe2++2H++NO3-=Fe3++NO2↑+H2O |
| C、碳酸镁溶于硝酸中:CO32-+2H+=CO2↑+H2O |
| D、Mg(HCO3)2溶液中加入过量的苛性钾溶液:Mg2++HCO3-+3OH-=Mg(OH)2+CO32-+H2O |
考点:离子方程式的书写,化学方程式的书写
专题:
分析:A.发生氧化还原反应生成硫酸钠;
B.发生氧化还原反应,遵循电子、电荷守恒;
C.碳酸镁在离子反应中保留化学式;
D.Mg(HCO3)2完全反应,生成氢氧化镁、碳酸钾和水.
B.发生氧化还原反应,遵循电子、电荷守恒;
C.碳酸镁在离子反应中保留化学式;
D.Mg(HCO3)2完全反应,生成氢氧化镁、碳酸钾和水.
解答:
解:A.SO2气体缓慢通入Na2O2粉末中的反应为Na2O2+SO2=Na2SO4,故A错误;
B.Fe(NO3)2浓溶液中通入HCl气体的离子反应为Fe2++2H++NO3-=Fe3++NO2↑+H2O,故B正确;
C.碳酸镁溶于硝酸中的离子反应为MgCO3+2H+=CO2↑+H2O+Mg2+,故C错误;
D.Mg(HCO3)2溶液中加入过量的苛性钾溶液的离子反应为Mg2++2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O,故D错误;
故选B.
B.Fe(NO3)2浓溶液中通入HCl气体的离子反应为Fe2++2H++NO3-=Fe3++NO2↑+H2O,故B正确;
C.碳酸镁溶于硝酸中的离子反应为MgCO3+2H+=CO2↑+H2O+Mg2+,故C错误;
D.Mg(HCO3)2溶液中加入过量的苛性钾溶液的离子反应为Mg2++2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应的考查,题目难度不大.注意离子方程式历来是化学教学中的重点,也是高考较为容易考查到的知识点,离子方程式的涉及面广,尤其是和氧化还原反应或因为反应物量不同导致的多可能反应结合起来,学生显得最为困难.本题的出现旨在引起学生对于离子方程式的重视.

练习册系列答案
相关题目
关于NaHCO3性质的有关叙述正确的是( )
| A、只能与酸反应 |
| B、医疗上可用于治疗胃酸过多 |
| C、与足量的酸反应时放出的CO2比与等质量的Na2CO3要少 |
| D、同温度时,NaHCO3的溶解度>Na2CO3溶解度 |
下列说法正确的是( )
A、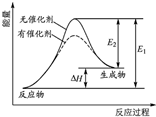 某反应的反应过程中能量变化如图所示,由如图分析可知催化剂不改变反应的焓变 | ||||||||||
| B、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | ||||||||||
C、已知:
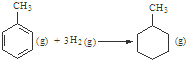 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 | ||||||||||
| D、常温下在0.10 mol?L-1的氨水中加入少量NH4Cl晶体,NH3?H2O的电离程度和溶液的pH均减小 |
NA代表阿伏加德罗常数的数值.下列说法中正确的是( )
| A、在1L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1 NA |
| B、1molCaC2中含有阴离子数目为2NA |
| C、120gNaHSO4在水溶液和熔融状态下电离出来的离子总数均为3NA |
| D、2mol SO2和1 mol O2混合气体在V2O5存在的条件下于密闭容器中加热反应后容器内物质分子数小于2NA |
下列表示对应化学反应的离子方程式错误的是( )
| A、向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
| B、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+O2↑ |
| C、向碳酸氢钙溶液中滴入少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向氨水中通入少量的二氧化硫气体:2NH3?H2O+SO2=2NH4++SO32-+H2O |