题目内容
下列变化中,需要加入氧化剂的是( )
| A、HCl→H2 |
| B、HCl→FeCl2 |
| C、H2SO4(浓)→SO2 |
| D、Fe→Fe2O3 |
考点:氧化还原反应
专题:
分析:需要加入氧化剂,则选项中为还原剂的反应,还原剂中某元素的化合价升高,以此来解答.
解答:
解:A.H元素化合价降低,被还原,应加入还原剂,故A错误;
B.HCl可与FeO发生复分解反应生成,不一定为氧化还原反应,故B错误;
C.S元素化合价降低,被还原,应加入还原剂,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂,故D正确.
故选D.
B.HCl可与FeO发生复分解反应生成,不一定为氧化还原反应,故B错误;
C.S元素化合价降低,被还原,应加入还原剂,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂,故D正确.
故选D.
点评:本题考查氧化还原反应,为高考高频考点,把握元素的化合价变化及氧化还原反应中基本概念为解答的关键,侧重氧化剂、还原剂的考查,题目难度不大.

练习册系列答案
相关题目
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A、空气、天然气、苛性钾、石灰石 |
| B、液态氯化氢、稀硫酸、硫酸钠晶体、二氧化硫 |
| C、盐酸、水煤气、醋酸、干冰 |
| D、纯碱、铝合金、冰水混合物、乙醇 |
1g氢气在氧气中完全燃烧生成液态水,放出142.9kJ热量,表示该反应的热化学方程式的是( )
A、H2(g)+
| ||
B、H2(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol | ||
D、H2+
|
下列各组离子,在指定的环境中能大量共存的是( )
| A、在中性的溶液中:Ag+、K+、SO42-、Cl- |
| B、pH=12的溶液中:Na+、S2-、AlO2-、SO32- |
| C、有CO32-存在的溶液中:Na+、Fe3+、Ca2+、I- |
| D、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |
关于NaHCO3性质的有关叙述正确的是( )
| A、只能与酸反应 |
| B、医疗上可用于治疗胃酸过多 |
| C、与足量的酸反应时放出的CO2比与等质量的Na2CO3要少 |
| D、同温度时,NaHCO3的溶解度>Na2CO3溶解度 |
下列说法正确的是( )
A、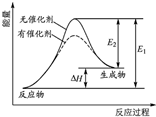 某反应的反应过程中能量变化如图所示,由如图分析可知催化剂不改变反应的焓变 | ||||||||||
| B、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | ||||||||||
C、已知:
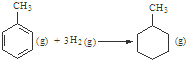 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 | ||||||||||
| D、常温下在0.10 mol?L-1的氨水中加入少量NH4Cl晶体,NH3?H2O的电离程度和溶液的pH均减小 |