题目内容
 下表是元素周期表前三周期的一部分,按要求作答:
下表是元素周期表前三周期的一部分,按要求作答:(1)R原子的基态核外电子排布是
(2)X的基态原子的轨道表示式是以下选项中的
A.

B.

C.泡利原理
D.洪特规则
(3)以上五种元素中,W与Y的第一电离能的大小顺序是
(4)五种元素中的电负性最大的是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置可知,X为氮元素,Y为硫元素,Z为氟元素,W为磷元素,R为氩元素,结合原子核外电子排布规律及第一电离能和电负性的比较答题;
解答:
解:根据元素在周期表中的位置可知,X为氮元素,Y为硫元素,Z为氟元素,W为磷元素,R为氩元素,
(1)R为氩元素,氩原子的基态核外电子排布是1s22s22p63s23p6,其核外共有18种不同运动状态的电子,故答案为:1s22s22p63s23p6;18;
(2)X为氮元素,它的基态原子的轨道表示式是 ,另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合泡利原理,
,另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合泡利原理,
故答案为:B;C;
(3)同周期元素,从左向右,第一电离能增大,但由于第ⅤA族元素最外层p轨道上电子处于半满状态,是一种稳定结构,所以第一电离能高于相邻同周期元素,所以,W与Y的第一电离能的大小顺序是P>S,
故答案为:P>S;第ⅤA族元素最外层p轨道上电子处于半满状态,是一种稳定结构,所以第一电离能高于相邻同周期元素;
(4)根据元素周期律,同周期元素周期律从左向右电负性逐渐增大,同主族元素,从上向下,电负性逐渐减弱,所以在上面五种元素中的电负性最大的是氟元素,
故答案为:F.
(1)R为氩元素,氩原子的基态核外电子排布是1s22s22p63s23p6,其核外共有18种不同运动状态的电子,故答案为:1s22s22p63s23p6;18;
(2)X为氮元素,它的基态原子的轨道表示式是
 ,另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合泡利原理,
,另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合泡利原理,故答案为:B;C;
(3)同周期元素,从左向右,第一电离能增大,但由于第ⅤA族元素最外层p轨道上电子处于半满状态,是一种稳定结构,所以第一电离能高于相邻同周期元素,所以,W与Y的第一电离能的大小顺序是P>S,
故答案为:P>S;第ⅤA族元素最外层p轨道上电子处于半满状态,是一种稳定结构,所以第一电离能高于相邻同周期元素;
(4)根据元素周期律,同周期元素周期律从左向右电负性逐渐增大,同主族元素,从上向下,电负性逐渐减弱,所以在上面五种元素中的电负性最大的是氟元素,
故答案为:F.
点评:本题主要考查了电子排布式、核外电子排布规律、第一电离能、电负性等知识点,中等难度,解题的关键在于元素的推断.

练习册系列答案
相关题目
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A、空气、天然气、苛性钾、石灰石 |
| B、液态氯化氢、稀硫酸、硫酸钠晶体、二氧化硫 |
| C、盐酸、水煤气、醋酸、干冰 |
| D、纯碱、铝合金、冰水混合物、乙醇 |
下列各组离子,在指定的环境中能大量共存的是( )
| A、在中性的溶液中:Ag+、K+、SO42-、Cl- |
| B、pH=12的溶液中:Na+、S2-、AlO2-、SO32- |
| C、有CO32-存在的溶液中:Na+、Fe3+、Ca2+、I- |
| D、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |
关于NaHCO3性质的有关叙述正确的是( )
| A、只能与酸反应 |
| B、医疗上可用于治疗胃酸过多 |
| C、与足量的酸反应时放出的CO2比与等质量的Na2CO3要少 |
| D、同温度时,NaHCO3的溶解度>Na2CO3溶解度 |
将0.1mol?L-1的下列物质的水溶液,从常温加热到80℃,溶液的pH几乎不变的( )
| A、氯化钾 | B、氢氧化钠 |
| C、硫酸 | D、水 |
短周期主族元素X、Y、Z、W在元素周期表中的位置关系如图,下列推论合理的是( )
| X | Y |
| W | Z |
| A、若Z的核电荷数是Y的两倍,则X为碳元素 |
| B、若W的核电荷数是Y的两倍,则X是氮元素 |
| C、原子半径:Z>Y>X |
| D、最简单氢化物的稳定性:Y>X>W |
下列说法正确的是( )
A、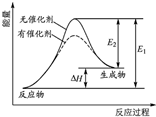 某反应的反应过程中能量变化如图所示,由如图分析可知催化剂不改变反应的焓变 | ||||||||||
| B、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | ||||||||||
C、已知:
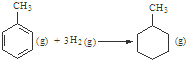 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 | ||||||||||
| D、常温下在0.10 mol?L-1的氨水中加入少量NH4Cl晶体,NH3?H2O的电离程度和溶液的pH均减小 |