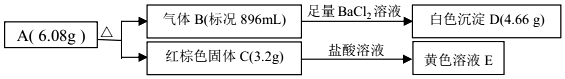
题目内容
1.今有氢氧化钠和碳酸钠混合溶液100mL,为了测定此混合溶液中各物质的质量,进行下列实验.(1)在用0.10mo1/L标准盐酸溶液润洗后的酸式滴定管中,注入0.10mol/L的标准盐酸溶液,调节滴定管的尖嘴部分至尖嘴处充满液体,并记下管内液面所在刻度为2.23mL.
(2)用碱式滴定管(填仪器名称)取混合溶液20.00mL,注入200mL的锥形瓶(填仪器名称)中,加入几滴酚酞试
液,振荡均匀后,把容器放在滴定管下,并在容器下面放一张白纸,其作用是便于观察锥形瓶中溶液颜色变化.
(3)向容器中小心地滴入盐酸,边滴边振荡,直至因加入一滴酸后容器内液体由红色恰好变为无色时为止,记下滴定管液面所在刻度为27.74mL.至此溶液中发生了如下变化:NaOH+HCl→NaCl+H2O、Na2CO3+HCl→NaHCO3+NaCl.再向容器中滴入几滴甲基橙试液,振荡,使溶液充分混和,这时溶液呈黄色色,小心地再向溶液中滴入标准盐酸直至因加入一滴酸后溶液颜色变为橙色即为终点,记下滴定管液面所在刻度为35.40 mL,此溶液中又发生了如下反应:NaHCO3+HCl→NaCl+H2O+CO2↑
(4)由以上实验结果计算出:在1L原试液中含氢氧化钠3.570g;含碳酸钠4.060g.
分析 (1)滴定管使用时尖嘴处充满液体;
(2)氢氧化钠和碳酸钠混合溶液显碱性,需要用碱式滴定管取用20.00ml溶液,实验中待测液取用后放在锥形瓶中,加入几滴酚酞试液,振荡均匀后,把容器放在滴定管下,并在容器下面放一张白纸,便于观察锥形瓶中溶液颜色变化;
(3)滴入酚酞的混合溶液中滴入盐酸发生反应NaOH+HCl→NaCl+H2O、Na2CO3+HCl→NaHCO3+NaCl,再向容器中滴入几滴甲基橙试液,振荡,使溶液充分混和,混合溶液呈碱性,这时溶液呈黄色;
(4)取混合溶液20.00mL,滴入酚酞用0.10mol/L的标准盐酸溶液滴定,边滴边振荡,直至因加入一滴酸后容器内液体由红色恰好变为无色时为止,记下滴定管液面所在刻度为27.74mL,此时消耗溶液体积=27.74mL-2.23mL=25.51ml,至此溶液中发生了如下变化:NaOH+HCl→NaCl+H2O、Na2CO3+HCl→NaHCO3+NaCl,再向容器中滴入几滴甲基橙试液,小心地再向溶液中滴入标准盐酸直至因加入一滴酸后溶液颜色变为橙色发生反应NaHCO3+HCl→NaCl+H2O+CO2↑,消耗标准溶液体积35.40 mL-27.74mL=7.660ml,结合定量关系计算.
解答 解:(1)在用0.10mo1/L标准盐酸溶液润洗后的酸式滴定管中,注入0.10mol/L的标准盐酸溶液,调节滴定管的尖嘴部分至尖嘴处充满液体,
故答案为:尖嘴处充满液体;
(2)氢氧化钠和碳酸钠混合溶液显碱性,需要用碱式滴定管取用20.00ml溶液,取混合溶液20.00mL,注入200mL的锥形瓶中,加入几滴酚酞试液,振荡均匀后,把容器放在滴定管下,并在容器下面放一张白纸,便于观察锥形瓶中溶液颜色变化,
故答案为:碱式滴定管;锥形瓶;便于观察锥形瓶中溶液颜色变化;
(3)滴入酚酞的混合溶液中滴入盐酸发生反应NaOH+HCl→NaCl+H2O、Na2CO3+HCl→NaHCO3+NaCl,再向容器中滴入几滴甲基橙试液,振荡,使溶液充分混和,混合溶液呈碱性,这时溶液呈黄色,小心地再向溶液中滴入标准盐酸直至因加入一滴酸后溶液颜色变为橙色即为终点,此溶液中又发生了如下反应:NaHCO3+HCl→NaCl+H2O+CO2↑,
故答案为:黄;橙;
(4)取混合溶液20.00mL,滴入酚酞用0.10mol/L的标准盐酸溶液滴定,边滴边振荡,直至因加入一滴酸后容器内液体由红色恰好变为无色时为止,记下滴定管液面所在刻度为27.74mL,此时消耗溶液体积=27.74mL-2.23mL=25.51ml,至此溶液中发生了如下变化:NaOH+HCl→NaCl+H2O、Na2CO3+HCl→NaHCO3+NaCl,再向容器中滴入几滴甲基橙试液,小心地再向溶液中滴入标准盐酸直至因加入一滴酸后溶液颜色变为橙色发生反应NaHCO3+HCl→NaCl+H2O+CO2↑,消耗标准溶液体积35.40 mL-27.74mL=7.660ml,碳酸氢钠物质的量和碳酸钠物质的量相同,20ml溶液中含碳酸钠和氢氧化钠为:n(Na2CO3)=n(NaHCO3)=0.00766L×0.10mol/L=7.66×10-4mol,碳酸钠质量=7.66×10-4mol×106g/mol=0.0812g,n(NaOH)=0.0255L×l×0.10mol/L-7.66×10-4mol=1.784×10-3mol,氢氧化钠质量=1.784×10-3mol×40g/mol=0.0714g,所以1L溶液中含氢氧化钠质量=0.0714g×$\frac{1000}{20}$=3.570g,含碳酸钠质量=0.0812g×$\frac{1000}{20}$=4.060g,
故答案为:3.570;4.060.
点评 本题考查了物质组成的实验探究和实验测定、主要是滴定实验和滴定注意问题和数据处理的分析,掌握基础是解题关键,题目难度中等.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| 选项 | 项目 | 分析 |
| A | 制备乙烯、制备硝基苯 | 实验时均用到了温度计 |
| B | 乙烯制备乙醇、氯乙烷制备乙醇 | 属于同一反应类型 |
| C | 丙烯可以使溴水和酸性高锰酸钾溶液褪色 | 褪色原理不同 |
| D | 乙醇燃烧、乙醇使重铬酸钾变色 | 均为氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
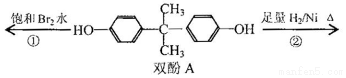
| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1mol双酚A最多消耗2mol Br2 | |
| C. | 反应②的产物中只有一种官能团 | |
| D. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 |
| A. | 锂离子电池和普通锌锰干电池都是二次电池 | |
| B. | 原电池的反应的本质是氧化还原反应 | |
| C. | 燃料电池是一种高效但是会污染环境的新型电池 | |
| D. | 铅蓄电池放电的时候正极是Pb负极是PbO2 |
| A. | 在25℃时,将amol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数:Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| B. | 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ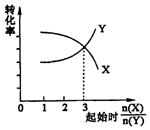 | |
| C. | 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+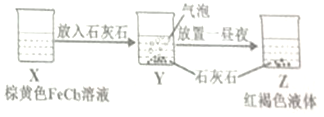 | |
| D. | 将10mL 1 mol•L-1Na2CO3溶液逐滴滴加到10mL1mol•L-1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
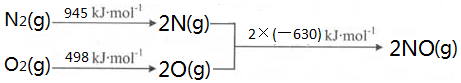
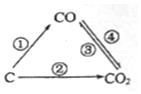 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.