题目内容
13.某盐 A是由三种元素组成的化合物,某研究小组按如图流程探究其组成: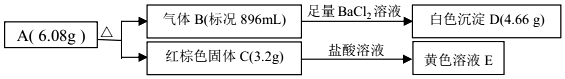
请回答:
(1)写出红棕色固体 C 的化学式Fe2O3.
(2)写出 A 受热分解反应的化学方程式2FeSO4═Fe2O3+SO3↑+SO2↑.
(3)写出气体 B 与溶液 E 反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 n(B)=$\frac{0.896ml}{22.4l/mol}$=0.04mol,生成白色沉淀D为BaSO4,且n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,说明n(SO3)=0.02mol,红综合固体为Fe2O3,n(Fe2O3)=$\frac{3.2g}{160g/mol}$=0.02mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.02mol,以此解答该题.
解答 解:n(B)=$\frac{0.896ml}{22.4l/mol}$=0.04mol,生成白色沉淀D为BaSO4,且n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,说明n(SO3)=0.02mol,红综合固体为Fe2O3,n(Fe2O3)=$\frac{3.2g}{160g/mol}$=0.02mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.02mol,
(1)由以上分析可知C为Fe2O3,
故答案为:Fe2O3;
(2)由以上分析可知n(SO3)=0.02mol,n(SO2)=0.02mol,n(Fe2O3)=0.02mol,且m(SO3)+m(SO2)+m(Fe2O3)=0.02mol×80g/mol+0.02mol×64g/mol+3.2g=6.08g,说明A中n(Fe):n(S):n(O)=1:1:4,A为FeSO4,分解的方程式为2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑,
故答案为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑;
(3)气体 B 为二氧化硫和三氧化硫,与溶液 E为氯化铁溶液 反应,发生氧化还原反应生成氯化亚铁、硫酸,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
点评 本题考查无机物的推断以及物质的组成的判断,为高频考点,把握二氧化硫的性质、铁离子检验为解答的关键,侧重分析与推断能力的考查,注意从质量守恒的角度判断A的化学式,题目难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
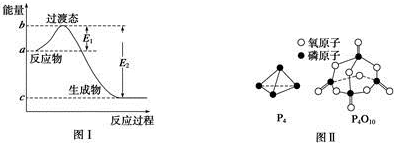
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)=H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-764.7KJ/mol.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
| A. | 放电时Li+由正极向负极移动 | |
| B. | M可能为羧酸、醇等含活泼氢的有机物 | |
| C. | 充电时的阳极反应为LixC-xe-=C+xLi+ | |
| D. | 钾离子电池的比能量(单位质量释放的能量)低 |
| A. | 食用醋就是冰醋酸 | B. | 医用酒精浓度为75% | ||
| C. | 钢铁生锈主要是发生了析氢腐蚀 | D. | 汽车尾气的排放会引起臭氧空洞 |
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 17 g H2O2中含有8NA个电子 | |
| C. | 7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA | |
| D. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA |
| A. | 石油产品--直馏汽油和裂化汽油的成分相同 | |
| B. | 获得上述化石能源的过程均为化学变化 | |
| C. | 水煤气是通过煤的液化得到的气体燃料 | |
| D. | 天然气是一种清洁能源 |
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.