题目内容
11.下列说法不正确的是( )| A. | 在25℃时,将amol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数:Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| B. | 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ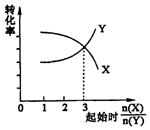 | |
| C. | 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+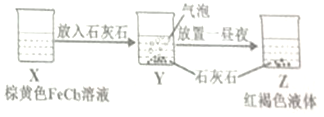 | |
| D. | 将10mL 1 mol•L-1Na2CO3溶液逐滴滴加到10mL1mol•L-1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
分析 A.在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$;
B.当反应物的起始物质的量之比等于化学计量数之比,物质的转化率相同,据此由图可知$\frac{n(x)}{n(y)}$=3时,转化率相同,即X与Y的化学计量数之比为3:1;
C.氯化铁溶液由于铁离子水解,溶液显酸性,加入碳酸钙,碳酸钙与氢离子反应生成二氧化碳气体,使铁离子的水解平衡正向移动;
D.将10ml 1 mol•L-1Na2CO3溶液逐滴滴加到10ml 1 mol•L-1盐酸中,碳酸钠和盐酸反应生成二氧化碳、水和氯化钠,碳酸钠过量,所得溶液为等物质的量浓度的碳酸钠和氯化钠的混合溶液,碳酸钠电离出钠离子和碳酸根离子,氯化钠电离出钠离子和氯离子,碳酸根离子部分水解生成碳酸氢根离子,依此进行判断.
解答 解:A.在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,故A正确;
B.当反应物的起始物质的量之比等于化学计量数之比,物质的转化率相同,据此由图可知$\frac{n(x)}{n(y)}$=3时,转化率相同,即X与Y的化学计量数之比为3:1,故B错误;
C.氯化铁溶液由于铁离子水解,溶液显酸性,加入碳酸钙,碳酸钙与氢离子反应生成二氧化碳气体,使铁离子的水解平衡正向移动,故反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+,故C正确;
D.将10ml 1 mol•L-1Na2CO3溶液逐滴滴加到10ml 1 mol•L-1盐酸中,碳酸钠和盐酸反应生成二氧化碳、水和氯化钠,碳酸钠过量,所得溶液为等物质的量浓度的碳酸钠和氯化钠的混合溶液,碳酸钠电离出钠离子和碳酸根离子,氯化钠电离出钠离子和氯离子,碳酸根离子部分水解生成碳酸氢根离子,故滴加结束后生成的溶液中有:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-),故D正确;
故选B.
点评 本题考查化学平衡图象与计算,电离常数的计算,水解平衡的移动及离子方程式的书写,离子浓度大小的比较,题目难度中等.

| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 17 g H2O2中含有8NA个电子 | |
| C. | 7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA | |
| D. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA |
| A. | CH3CH2OH | B. | CH3COOC2H5 | C. | CH3OH | D. | CH3COOCH3 |
| A. | 苯乙烯属于芳香烃,也属于苯的同系物 | |
| B. | 相对分子质量相等的两种有机物必定是同分异构体 | |
| C. | 官能团相同的物质一定是同一类物质,例如含有苯环的烃都是芳香烃 | |
| D. | 由乙醇制备乙二酸二乙酯,发生的反应依次为消去、加成、取代、氧化、酯化 |
| A. | 石油产品--直馏汽油和裂化汽油的成分相同 | |
| B. | 获得上述化石能源的过程均为化学变化 | |
| C. | 水煤气是通过煤的液化得到的气体燃料 | |
| D. | 天然气是一种清洁能源 |
| A. | 0.2 mol•L-l•s-l | B. | 0.4 mol•L-l•s-l | C. | 0.6 mol•L-l•s-l | D. | 0.8 mol•L-l•s-l |