题目内容
6.如图所示各物质是由短周期元素组成的单质及其化合物,图中部分反应条件及生成物未列出.其中A、D、K为单质,其元素在周期表中分处不同周期,且原子最外层电子数:A原子是D原子的两倍,K原子是A原子的两倍;E是能使湿润的红色石蕊试纸变蓝的气体,工业上常用C的无水晶体制备A.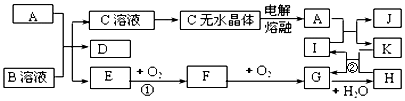
请按要求回答:
(1)写出A的化学式 Mg,I的电子式
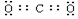 .
.(2)从C溶液制备C无水晶体的操作要点是 将C溶液先蒸发浓缩结晶,后将晶体在干燥的HCl气流中加热脱去结晶水,得无水氯化镁.
(3)写出有关反应的化学方程式:
反应①4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;反应②C+4HNO3(浓)═CO2+4NO2↑+2H2O.
(4)常温下,B溶液的pH < 7(填>、<或=),请用离子方程式表示其原因:NH4++H2O?NH3•H2O+H+.
分析 由框图可知用电解法冶炼A,A可能为Na或Mg,且原子最外层电子数A原子是D原子的两倍,可知A的最外层电子数为偶数,应为Mg,E是能使湿润的红色石蕊试纸变蓝的气体,应为NH3,由转化关系可知C为MgCl2,则B应为NH4Cl,D为H2,F为NO,G为NO2,H为HNO3,I为CO2,J为MgO,K为C,以此解答该题.
解答 解:(1)由以上分析可知A为Mg,I为CO2,电子式为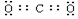 ,故答案为:Mg;
,故答案为:Mg;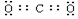 ;
;
(2)氯化镁溶液在加热时易发生水解而生成氢氧化镁沉淀,加热时应避免水解,可在酸性条件下进行加热,操作方法是将C溶液先蒸发浓缩结晶,后将晶体在干燥的HCl气流中加热脱去结晶水,得无水氯化镁,
故答案为:将C溶液先蒸发浓缩结晶,后将晶体在干燥的HCl气流中加热脱去结晶水,得无水氯化镁;
(3)反应①为氨气的催化氧化,方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,反应②为浓硝酸与碳的反应,方程式为C+4HNO3(浓)═CO2+4NO2↑+2H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;C+4HNO3(浓)═CO2+4NO2↑+2H2O;
(4)B为氯化铵,为强酸弱碱盐,水解呈酸性,pH<7,离子方程式为NH4++H2O?NH3•H2O+H+,
故答案为:<;NH4++H2O?NH3•H2O+H+.
点评 本题考查无机物的推断,为高考常见题型,侧重考查学生的分析能力,题目难度中等,根据物质的典型性质,明确物质的种类为解答该题的关键,题中注意E是能使湿润的红色石蕊试纸变蓝的气体为突破口,注意工业电解法冶炼镁.

练习册系列答案
相关题目
17. X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | X、Y、Z、W的原子序数递增 | |
| C. | X、W可形成化学式为XW的离子化合物 | |
| D. | 简单离子半径是Z大于W |
18.A、B、C、D、E六种物质的转化关系如图所示(未标出反应条件),A、D、F都是由短周期非金属元素形成的单质,B、C、E都是二元化合物.A、F所含元素同周期,下列说法不正确的是( )

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
14. 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
1.下列各项中,不能运用化学平衡移动原理解释的是( )
| A. | 实验室中用饱和食盐水除去氯气中的氯化氢气体 | |
| B. | 实验室中久置的浓氨水碱性减弱 | |
| C. | 向硝酸亚铁溶液中滴加盐酸,溶液变为黄色 | |
| D. | 在较高温度下测定二氧化氮气体相对分子质量 |
11.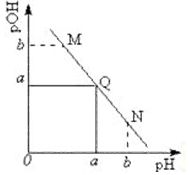 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A. | 溶液导电能力M点大于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | 图中b>7 |
18.在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1mol•L-1、0.05mol•L-1和0.3mol•L-1.当反应达平衡时不可能存在的数据正确的是( )
| A. | c(SO2)=0.25 mol•L-1 | B. | c(O2)=0.12 mol•L-1 | ||
| C. | c(SO2)+c(SO3)=0.15 mol•L-1 | D. | c(SO3)+c(O2)=0.3 mol•L-1 |
16.现有反应 3Fe(s)+4H2O(g)$\stackrel{△}{?}$ Fe3O4(s)+4H2(g),在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是( )
| A. | 增加H2的量 | |
| B. | 将容器体积缩小一半 | |
| C. | 保持容器内体积不变,充入Ar使体系压强增大 | |
| D. | 充入Ar,保持容器内压强不变 |