题目内容
3.室温下向10mL pH=11的稀氨水溶液中加入水稀释后,下列说法正确的是( )| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 氨水的电离程度增大,[OH-]减小 | |
| C. | 再加入10mL pH=3 HCl溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的[OH-]=1×10-3 mol•L-1 |
分析 A.加水稀释氨水,促进一水合氨电离,由于溶液体积变化大于离子的物质的量的变化,所以溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小;
B.由A分析判断;
C.pH=11的稀氨水氨水的浓度大于0.001mol/L,pH=3 HCl溶液的浓度为0.001mol/L;
D.pH=11的稀氨水中由水电离的氢离子为1×10-11 mol•L-1.
解答 解:A.加水稀释氨水,促进一水合氨电离,溶液中导电粒子的数目增加,由于溶液体积变化大于离子的物质的量的变化,所以溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,溶液的导电性减弱,故A错误;
B.加水稀释氨水,促进一水合氨电离,但是[OH-]减小,故B正确;
C.pH=11的稀氨水氨水的浓度大于0.001mol/L,pH=3 HCl溶液的浓度为0.001mol/L,二者混合氨水过量,溶液显碱性,故C错误;
D.pH=11的稀氨水中由水电离的氢离子为1×10-11 mol•L-1,则由水电离出的[OH-]=1×10-11 mol•L-1,故D错误;
故选B.
点评 本题考查了弱电解质的电离,根据电离程度及溶液中粒子浓度变化分析解答,易错选项是D,会根据离子关系进行变换,题目难度中等,侧重于考查学生的分析能力好计算能力.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
4.天冬酰苯丙氨酸甲酯的结构简式为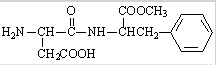 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )
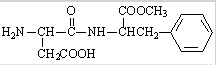 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )| A. | 在适当催化剂作用下可形成高分子化合物 | |
| B. | 该有机物完全燃烧时生成CO2、H2O、NH3 | |
| C. | 1mol该有机物在盐酸中发生水解反应时最多消耗2molH+ | |
| D. | 1mol该有机物最多能与3molNaOH反应 |
14.下列说法正确的是( )
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |
11.下列关于各图象的解释或结论正确的是( )
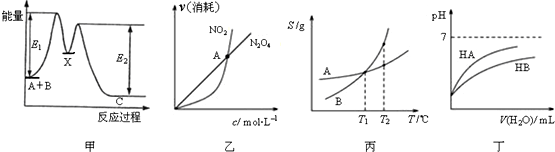

| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
18.室温下,将10mLpH=3的醋酸溶液加水稀释后,下列说法不正确是( )
| A. | 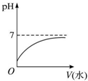 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
8.pH=3的两种酸溶液A、B,取等体积酸分别与足量的锌反应,酸A比酸B产生的氢气的量多.下列说法正确的是( )
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |