题目内容
8.pH=3的两种酸溶液A、B,取等体积酸分别与足量的锌反应,酸A比酸B产生的氢气的量多.下列说法正确的是( )| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
分析 pH=3的两种酸溶液,强酸完全电离,弱酸部分电离,与足量的金属锌反应,酸性弱的酸产生的氢气多,据此分析.
解答 解:pH=3的两种酸溶液,强酸完全电离,弱酸部分电离,与足量的金属锌反应,弱酸中氢离子被消耗会继续电离出氢离子,则产生的氢气多,酸A比酸B产生的氢气多,所以A酸性比B弱,但是B不一定为强酸.
故选D.
点评 本题考查电解质在水溶液中的电离,注意只能判断出酸性相对强弱,但不一定是强酸,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
相关题目
3.室温下向10mL pH=11的稀氨水溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 氨水的电离程度增大,[OH-]减小 | |
| C. | 再加入10mL pH=3 HCl溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的[OH-]=1×10-3 mol•L-1 |
13.下列关于NaOH溶液和氨水的说法正确的是( )
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
18.下列各组物质或物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |

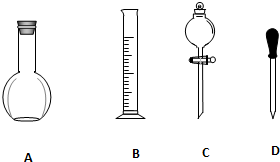 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;