题目内容
4.25℃时,pH=3的盐酸中由水电离出的H+离子浓度是pH=5的盐酸中由水电离的H+离子浓度的多少倍( )| A. | 10-2 | B. | 102 | C. | 2 | D. | 12 |
分析 盐酸抑制水的电离,pH=3的盐酸,c(H+)=10-3mol/L,pH=5的盐酸溶液中c(H+)=10-5mol/L,溶液中OH-全部由水电离产生,水电离出的c(H+)=c(OH-),以此解答.
解答 解:水的电离方程式为:H2O?H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=3的盐酸,c(H+)=10-3mol/L,由水电离生成的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,pH=5的盐酸,c(H+)=10-5mol/L,由水电离生成的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,
因此由水电离出的c(H+)之比为:10-11mol/L:10-9mol/L=10-2,故选A.
点评 本题考查了水的电离,为高频考点,侧重于学生的分析能力和计算能力的考查,可以根据常温下水的离子积计算出水电离氢离子浓度,关键是准确判断酸溶液和碱溶液中水的电离情况,难度不大.

练习册系列答案
相关题目
12.铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na 2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe 3+.
①铁酸钠中铁元素的化合价为+6.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾【KAl(SO4)2】一样起到净水作用,请说明明矾的净水原理:Al3++3H2O?Al(OH)3+3H+.(用离子方程式表示)
(2)反应ⅠFe(s)+CO 2 (g)?FeO(s)+CO(g)△H=a kJ?mol -1,平衡常数为K;
反应ⅡCO(g)+$\frac{1}{2}$O 2 (g)=CO 2 (g)△H=b kJ?mol -1 测得在不同温度下,K值如下:
①写出反应Ⅰ的K的表达式k=$\frac{C(CO)}{C(C{O}_{2})}$.
②反应Ⅰ中的a大于0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO 2 起始浓度为2mol?L -1,CO的平衡浓度为1mol?L -1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO 2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O 2(g)=2FeO(s)的△H=2(a+b)kJ?mol -1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为11.2g.
(1)铁酸钠(Na 2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe 3+.
①铁酸钠中铁元素的化合价为+6.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾【KAl(SO4)2】一样起到净水作用,请说明明矾的净水原理:Al3++3H2O?Al(OH)3+3H+.(用离子方程式表示)
(2)反应ⅠFe(s)+CO 2 (g)?FeO(s)+CO(g)△H=a kJ?mol -1,平衡常数为K;
反应ⅡCO(g)+$\frac{1}{2}$O 2 (g)=CO 2 (g)△H=b kJ?mol -1 测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应Ⅰ中的a大于0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO 2 起始浓度为2mol?L -1,CO的平衡浓度为1mol?L -1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO 2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O 2(g)=2FeO(s)的△H=2(a+b)kJ?mol -1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为11.2g.
19.下列物质:(1)Na(2)Br2 (3)Na2O (4)NO2(5)CO2(6)SO3(7)NH3(8)H2S(9)HCl (10)H2SO4 (11)Ba(OH)2(12)NaCl(13)蔗糖 (14)NaCl溶液,其中属于电解质的是( )
| A. | (1)(3)(6)(8)(9)(11) | B. | (2)(3)(6)(10)(11)(13) | C. | (3)(8)(9)(10)(11)(12) | D. | (4)(5)(7)(10)(11)(14) |
9.下列离子在溶液中因氧化还原反应而不能大量共存的是( )
| A. | Na+Ba2+ SO42- OH- | B. | Ag+ NO3? Cl?K+ | ||
| C. | H+ NO3-Fe2+ K+ | D. | Cu2+NH4+OH- SO42- |
16.真菌聚酮(X)具有多种生物活性,一定条件下可分别转化为Y和Z.
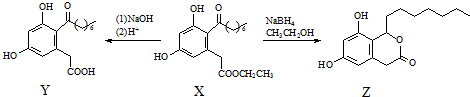
下列说法正确的是( )
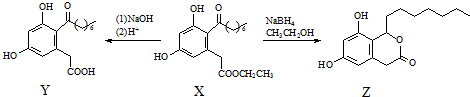
下列说法正确的是( )
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能发生氧化、还原、取代反应 | |
| C. | 一定条件下,1 mol X最多能与5 mol H2发生加成反应 | |
| D. | 1 mol Z最多可与含3 mol NaOH的溶液反应 |
13.玻璃棒是化学实验中最常用的一种仪器.下列实验中要用到玻璃棒的是( )
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
14.下列实验过程中,始终看不到明显变化的是( )
| A. | 向10mL0.1mol/LFeCl2溶液中缓缓通入标准状况下11.2mLCl2 | |
| B. | 向AlC13溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-的溶液中通入NO2 | |
| D. | 向5mL0.1mol/LNaOH溶液中,逐滴加入1mL0.1mol/LAlCl3溶液,边滴加边振荡 |
 .
. .
.