题目内容
1.乙酸与乙醇的酯化反应中,乙醇的结构简式为 C2H518OH,则反应一段时间后,18O原子存在于( )| A. | 存在于乙酸的分子中 | B. | 存在于乙醇的分子中 | ||
| C. | 存在于乙酸和乙酸乙酯分子中 | D. | 存在于乙醇和乙酸乙酯分子中 |
分析 根据酯化反应原理,反应中酸脱去羟基、醇脱去氢,乙酸在酯化反应中脱去羟基,断裂的是碳氧单键,乙醇在酯化反应中脱去羟基上的氢原子,断裂的是氢氧单键,用CH3COOH和CH3H218OH发生酯化反应,18O存在于乙酸和乙醇中,以此解答该题.
解答 解:乙酸与乙醇反应乙酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以乙酸与乙醇反应方程式为CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中.
故选D.
点评 本题考查有机物的结构和性质,侧重考查酯化反应的原理,为高频考点,题目难度不大,要求学生掌握酯化反应的原理及反应中乙酸和乙醇断裂化学键的位置,试题基础性强,侧重对学生基础知识的巩固和训练.

练习册系列答案
相关题目
12.铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na 2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe 3+.
①铁酸钠中铁元素的化合价为+6.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾【KAl(SO4)2】一样起到净水作用,请说明明矾的净水原理:Al3++3H2O?Al(OH)3+3H+.(用离子方程式表示)
(2)反应ⅠFe(s)+CO 2 (g)?FeO(s)+CO(g)△H=a kJ?mol -1,平衡常数为K;
反应ⅡCO(g)+$\frac{1}{2}$O 2 (g)=CO 2 (g)△H=b kJ?mol -1 测得在不同温度下,K值如下:
①写出反应Ⅰ的K的表达式k=$\frac{C(CO)}{C(C{O}_{2})}$.
②反应Ⅰ中的a大于0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO 2 起始浓度为2mol?L -1,CO的平衡浓度为1mol?L -1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO 2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O 2(g)=2FeO(s)的△H=2(a+b)kJ?mol -1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为11.2g.
(1)铁酸钠(Na 2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe 3+.
①铁酸钠中铁元素的化合价为+6.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾【KAl(SO4)2】一样起到净水作用,请说明明矾的净水原理:Al3++3H2O?Al(OH)3+3H+.(用离子方程式表示)
(2)反应ⅠFe(s)+CO 2 (g)?FeO(s)+CO(g)△H=a kJ?mol -1,平衡常数为K;
反应ⅡCO(g)+$\frac{1}{2}$O 2 (g)=CO 2 (g)△H=b kJ?mol -1 测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应Ⅰ中的a大于0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO 2 起始浓度为2mol?L -1,CO的平衡浓度为1mol?L -1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.通入CO 2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O 2(g)=2FeO(s)的△H=2(a+b)kJ?mol -1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为11.2g.
9.下列离子在溶液中因氧化还原反应而不能大量共存的是( )
| A. | Na+Ba2+ SO42- OH- | B. | Ag+ NO3? Cl?K+ | ||
| C. | H+ NO3-Fe2+ K+ | D. | Cu2+NH4+OH- SO42- |
16.真菌聚酮(X)具有多种生物活性,一定条件下可分别转化为Y和Z.
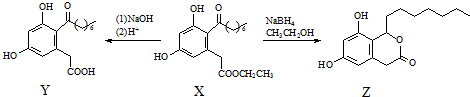
下列说法正确的是( )
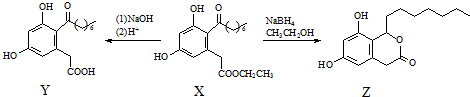
下列说法正确的是( )
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能发生氧化、还原、取代反应 | |
| C. | 一定条件下,1 mol X最多能与5 mol H2发生加成反应 | |
| D. | 1 mol Z最多可与含3 mol NaOH的溶液反应 |
6.48克碳在3.5mol氧气中不完全燃烧,待反应物耗尽,且
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
| A. | 1132 kJ | B. | 283kJ | C. | 442 kJ | D. | 990.5kJ |
13.玻璃棒是化学实验中最常用的一种仪器.下列实验中要用到玻璃棒的是( )
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.请用相关的化学术语回答下列问题:
(1)在这些元素中,最不活泼的是Ar,非金属性最强的是O,金属性最强的是K;
(填元素符号或化学式,下同.)
(2)这些元素形成的最高价氧化物对应的水化物中碱性最强的KOH,酸性最强的HClO4;
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为K>Na>Mg>Al>C;
(4)⑥的氢化物的电子式为 ,
,
①在空气中燃烧后生成产物的电子式 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(填元素符号或化学式,下同.)
(2)这些元素形成的最高价氧化物对应的水化物中碱性最强的KOH,酸性最强的HClO4;
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为K>Na>Mg>Al>C;
(4)⑥的氢化物的电子式为
 ,
,①在空气中燃烧后生成产物的电子式
 .
.