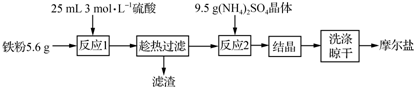
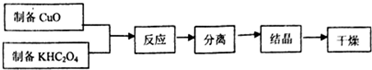
题目内容
6.下列说法中正确的是( )| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为△H=-57.3kJ/mol | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确) | |
| D. | 向存在着FeCl3 (黄色)+3KSCN?Fe(SCN)3(血红色)+3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化 |
分析 A、浓硫酸稀释,放出热量;醋酸为弱电解质,电离过程吸收热量;
B、物质的能量越低,越稳定;
C、用待测液润洗锥形瓶,溶质的物质的量偏大;
D、根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
解答 解:A、浓硫酸稀释,放出热量,中和热△H<0,所以测得的中和热△H<-57.3kJ/mol;醋酸为弱电解质,电离过程吸收热量,中和热△H<0,所以测得的中和热△H>-57.3kJ/mol,故A错误;
B、由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol可知,金刚石能量高,物质的能量越高,越不稳定,所以金刚石比石墨不稳定,故B错误;
C、用待测液润洗锥形瓶,溶质的物质的量偏大,造成V(标准)偏大,所测浓度偏高,故C错误;
D、根据实际参加反应的离子浓度分析,化学平衡为:Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,溶液颜色不变,平衡不动,故D正确;
故选D.
点评 本题考查了中和热、物质的稳定性、中和滴定中锥形瓶的使用方法以及化学平衡等知识,题目难度不大,试题注重了基础知识的考查,有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
15.下列物质的转化在给定条件下能实现的是( )
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | |
| D. | Cu(OH)2 $\stackrel{HNO_{3}(ap)}{→}$Cu(NO3)2(aq)$\stackrel{蒸发}{→}$Cu(NO3)2晶体 |
1.进行中和滴定实验使用的下列仪器,用蒸馏水洗涤后立即使用,不会引起实验误差的是( )
| A. | 酸式滴定管 | B. | 锥形瓶 | C. | 碱式滴定管 | D. | 以上均不正确 |
16.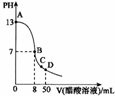 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A. | 曲线上任一点:c(Na+)+c(H+)=c(0H-)+c(CH3C00H) | |
| B. | 在 B点,a=25,且有 c(Na+)=c(CH3C00-)>c(0H-)=c(H+) | |
| C. | 在C点:c(Na+)>c(CH3C00-)>c(H+)>c(0H-) | |
| D. | 在D点:c(CH3C00-)+c(CH3C00H)=2c(Na+) |
 乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O