题目内容
11. 乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O该组同学设计了如下滴定方法测定x的值.
①称取1.260g纯草酸晶体,将其制成100.00m水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,
达到反应终点时消耗了10.00mL;
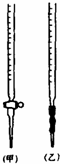
请回答:(1)滴定时,将KMnO4标准溶液装在图中的甲(选填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志是当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
(3)①通过上述数据,可计算出x=2.
讨论:②若滴定终点时俯视滴定管刻度,则由此测得的x值会偏大(选填“偏大”、“偏小”或“不变”,下同).
③若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会偏小.(同上)
分析 (1)甲为酸式滴定管,乙为碱式滴定管,KMnO4具有强氧化性,会腐蚀橡胶管;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)①由题给化学方程式及数据可得出x,
②③根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差,从而判断对测得的x值的影响.
解答 解:(1)甲为酸式滴定管,乙为碱式滴定管,因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装;
故答案为:甲;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色,
故答案为:当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;
(3)①由题给化学方程式:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O及数据可知,1.260g纯草酸晶体中含H2C2O4的物质的量为:0.1000 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100mL}{25mL}$=0.0100 mol,则1.260gH2C2O4•xH2O中含H2O的物质的量为$\frac{1.260g-0.0100mol×90g/mol}{18g/mol}$=0.020 0 mol,则0.01×x=0.02,可知x=2,
故答案为:2;
②若滴定终点时俯视滴定管刻度,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大,故答案为:偏大;
③若滴定时所用的KMnO4溶液因久置而导致浓度变小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏小,故答案为:偏小.
点评 本题考查氧化还原滴定实验,掌握实验的原理是解题的关键,难度适中,注意掌握草酸含量的计算方法及滴定中的误差分析即可解答.

| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
| A. | 元素的原子半径为d>c>b>a | |
| B. | b,d元素形成的最高价氧化物对应的水化物的酸性b>d | |
| C. | c与其它3种元素均能形成离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可能为酸性、也可能为碱性 |
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为△H=-57.3kJ/mol | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确) | |
| D. | 向存在着FeCl3 (黄色)+3KSCN?Fe(SCN)3(血红色)+3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化 |
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
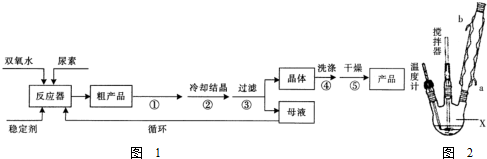
请回答下列问题:
(1)仪器X的名称是三颈烧瓶;冷凝管中冷却水从b(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是防止双氧水和过氧化尿素分解.
(3)搅拌器是否可用铁质材料否(填“是”或“否”),原因是铁和双氧水反应生成铁离子,促进双氧水分解;
(4)步骤①宜采用的操作是C.
A.加热蒸发 B.常压蒸发 C.减压蒸发
(5)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是沿玻璃棒注入蒸馏水至浸没晶体表面,静置待水自然流下,重复操作2-3次.
(6)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol•L-1H2SO4,用0.2000mol•L-1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为84.6%;若滴定后俯视读数,则测得的过氧化尿素含量偏低(填“偏高”、“偏低”或“不变”).
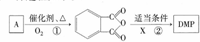
 )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: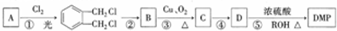
 .
. .
.