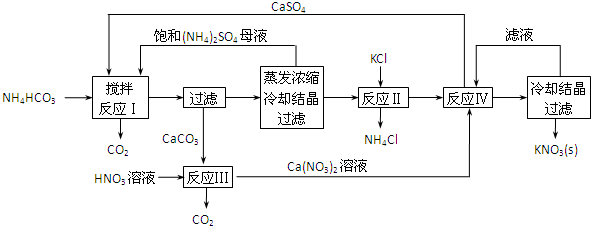
题目内容
12.1molP与$\frac{5}{3}$molCl2充分反应,生成PCl3和PCl5.求生成PCl3和PCl5的物质的量之比5:1.分析 设生成PCl3为xmol,PCl5为ymol,根据P和Cl守恒,建立关系式计算.
解答 解:设生成PCl3为xmol,PCl5为ymol,根据P和Cl守恒,n(P)=1mol,n(Cl)=$\frac{5}{3}$mol×2=$\frac{10}{3}$mol,建立关系式:
$\left\{\begin{array}{l}{x+y=1}\\{3x+5y=\frac{10}{3}}\end{array}\right.$ 解出$\left\{\begin{array}{l}{x=\frac{5}{6}}\\{y=\frac{1}{6}}\end{array}\right.$
所以 PCl3和PCl5的物质的量之比为:$\frac{x}{y}$=$\frac{5}{6}$:$\frac{1}{6}$=5:1,
故答案为:5:1.
点评 本题考查磷与氯气反应,与氯气的量有关,可用方程式解题,但常用原子守恒法建立方程组解题更简单,这也是中学计算题要用到的重要方法.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
2.下列既属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片与稀盐酸反应 | B. | 氢氧化钡与氯化铵的反应 | ||
| C. | 灼热的碳与水蒸气的反应 | D. | 铝热反应 |
3. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法正确的是( )| A. | N4分子属于一种新型的化合物 | B. | N4分子中只含有共价键 | ||
| C. | 1 mol N4分子所含共价键数为4NA | D. | N4沸点比P4(白磷)高 |
20.下列设计的实验方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
7. 如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
 如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )| A. | a点和b点的Ksp:a<b | |
| B. | 向溶液a中加入CaO并恢复原温度时,溶液的pH不变 | |
| C. | b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:s(H2O)>s(NaOH) | |
| D. | 溶解速率:b点>a点 |
17.原子序数依次增大的四种短周期元素a、b、c、d,a存在a+和a-两种离子,b和d为同一主族元素,b2-和c+的电子层结构相同,下列叙述正确的是( )
| A. | 元素的原子半径为d>c>b>a | |
| B. | b,d元素形成的最高价氧化物对应的水化物的酸性b>d | |
| C. | c与其它3种元素均能形成离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可能为酸性、也可能为碱性 |
6.下列说法中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为△H=-57.3kJ/mol | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确) | |
| D. | 向存在着FeCl3 (黄色)+3KSCN?Fe(SCN)3(血红色)+3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化 |
4.下列对实验现象的预测与实际相符的是( )
| 选项 | 实验 | 预测现象 |
| A | 将SO2通入紫色石蕊溶液中 | 石蕊溶液先变红后褪色 |
| B | 将CO2气体通入足量的CaCl2溶液中 | 产生白色沉淀 |
| C | 常温下,将用砂纸打磨过的铝片投入浓硫酸中 | 产生刺激性气体 |
| D | 将酸性高锰酸钾溶液滴入足量的乙醇中 | 高锰酸钾溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |