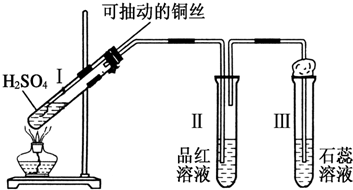
题目内容
5.下列对碱金属性质的叙述中,正确的是( )| A. | 单质的熔沸点随着原子序数的增加而升高 | |
| B. | 碱金属单质与水剧烈反应生成碱和氢气 | |
| C. | 单质在空气中燃烧生成的都是过氧化物 | |
| D. | 都是银白色的软金属,密度都较小 |
分析 A.碱金属为金属晶体,熔沸点与金属键强弱有关;
B.碱金属单质,性质活泼,与水剧烈反应生成碱和氢气;
C.锂在空气中燃烧生成氧化锂;
D.铯是金黄色的金属;
解答 解:A.碱金属都是金属晶体,随着原子序数递增,原子半径增大,金属键逐渐减弱,所以从上到下熔沸点依次降低,故A错误;
B.碱金属单质,性质活泼,都能与水剧烈反应生成碱和氢气,故B正确;
C.在空气中燃烧生成氧化锂,故C错误;
D.铯是金黄色,不是银白色,故D错误;
故选:B.
点评 本题考查了碱金属的性质,本题考查了,注意抓住碱金属性质递变规律分析判断,掌握基础是关键,注意金属晶体熔沸点规律,题目比较简单.

练习册系列答案
相关题目
16.下列反应既是氧化还原,又是吸热反应的是( )
| A. | 镁条与稀H2SO4反应 | |
| B. | 乙醇在氧气中的燃烧反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl | |
| D. | 炽热的焦炭和水蒸气反应制取水煤气 |
17.向0.4mol/L 500mL的石灰水中通入SO2气体,得12g白色沉淀,则SO2的体积可能为( )
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
14.下列有关实验说法正确的是( )
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 | |
| C. | 铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再各加一小块(绿豆大小)吸干煤油的金属钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
15.不使用其它试剂,区分①CuSO4②NaOH③NaCl④HCl的可能先后顺序是( )
| A. | ①③②④ | B. | ①②③④ | C. | ④①③② | D. | ②①③④ |
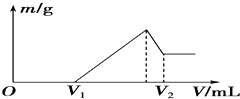 0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:
0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答: