题目内容
13. 0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:
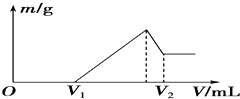
0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=180mL时,则金属粉末中n(Mg)=0.08 mol,V2=420mL.
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL.
(3)若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL 3mol•L-1硫酸溶解此混合物后,再加入 1mol•L-1NaOH溶液,所得沉淀最多时NaOH溶液的体积=0.6L.
分析 (1)根据图象可知,在滴加NaOH溶液到体积V1=180mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,剩余的H2SO4与滴加的NaOH恰好完全反应时,溶质是MgSO4、Al2(SO4)3和Na2SO4混合液,令MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液,根据守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al),进而计算氢氧化钠溶液体积;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4),再计算氢氧化钠溶液体积;
(3)沉淀最大时,溶液中溶质是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4),再计算氢氧化钠溶液体积.
解答 解:(1)100mL 2mol•L-1的H2SO4溶液中硫酸的物质的量为0.1L×2mol/L=0.2mol,
当V1=180mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.18L×1mol/L=0.09mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.2-0.09
联立方程,解得:x=0.08;y=0.01
所以金属粉末中n(Mg)=0.08mol,n(Al)=2y=2×0.01mol=0.02mol
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol×+0.02mol=0.42mol,所以,V2=$\frac{0.42mol}{1mol/L}$=0.42L=420mL,
故答案为:0.08;420;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以V(NaOH)=$\frac{0.4mol}{1mol/L}$=0.4L=400mL,
故答案为:400;
(3)沉淀最大时,溶液中溶质是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×3mol/L=0.6mol,所以V(NaOH)=$\frac{0.6mol}{1mol/L}$=0.6L,
故答案为:0.6.
点评 本题以图象形式考查混合物计算,清楚每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,注意守恒思想的运用.

 阅读快车系列答案
阅读快车系列答案| A. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-11.46 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-11.46 kJ•mol-1 | |
| C. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| D. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
| A. | 66.6% | B. | 42% | C. | 50% | D. | 33.3% |
| A. | NH4Cl | B. | Cu | C. | SiO2 | D. | I2 |
| A. | 该有机物的一溴代物最多有6种同分异构体 | |
| B. | 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 | |
| C. | 该有机物分子中的所有原子可能在同一平面上 | |
| D. | 该有机物不能发生加成反应,但能发生取代反应 |
| A. | 单质的熔沸点随着原子序数的增加而升高 | |
| B. | 碱金属单质与水剧烈反应生成碱和氢气 | |
| C. | 单质在空气中燃烧生成的都是过氧化物 | |
| D. | 都是银白色的软金属,密度都较小 |
| A. | 3CH4•H2O | B. | CH4•3H2O | C. | CH4•6H2O | D. | CH4•8H2O |