题目内容
10.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.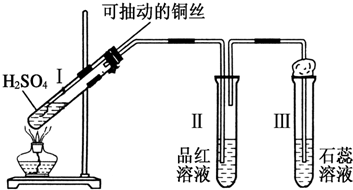
请回答下列问题:
(1)试管Ⅰ中发生反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)可抽动铜丝的作用是抽动铜丝,以随时中止反应.
(3)试管Ⅱ中现象为品红溶液褪色;可证明SO2具有漂白性.试管Ⅲ中现象为石蕊溶液显红色,可证明SO2溶于水显酸性;
(4)试管Ⅲ的管口用浸有碱(NaOH溶液)的棉团塞住其作用是吸收SO2气体,防止空气污染;发生反应的化学方程式为SO2+2NaOH=Na2SO3+H2O.
分析 (1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)通过抽动铜丝可以控制反应的停止;
(3)试管Ⅱ中装有品红溶液,二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫溶液显示酸性,所以试管Ⅲ中石蕊试液变红;
(4)二氧化硫为污染气体,需要用氢氧化钠溶液吸收多余的二氧化硫;二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水.
解答 解:(1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)通过抽动铜丝,以随时中止反应,避免浪费原料、减少污染气体的产生,
故答案为:抽动铜丝,以随时中止反应;
(3)二氧化硫具有漂白性,所以试管Ⅱ中品红溶液褪色;二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,所以试管Ⅲ中的石蕊溶液显红色,证明了二氧化硫的水溶液显示酸性,
故答案为:品红溶液褪色;SO2具有漂白性;石蕊溶液显红色;SO2溶于水显酸性;
(4)二氧化硫有毒,多余的气体不能直接排放,需要用氢氧化钠溶液吸收SO2气体,防止空气污染,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:吸收SO2气体,防止空气污染;SO2+2NaOH=Na2SO3+H2O.
点评 本题考查了浓硫酸的化学性质,题目难度中等,注意掌握铜与浓硫酸的反应原理,明确二氧化硫的性质及检验方法,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.下列有关实验的操作正确的是( )
| 实验 | 操作 | |
| A | 制取氢氧化铁胶体 | 向沸腾的蒸馏水中按适当比例滴加FeCl3饱和溶液,继续加热至液体呈红褐色,停止加热 |
| B | 稀释浓硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| C | 浓氨水与生石灰反应制备干燥的NH3 | 气体产物通过浓硫酸后,用向下排空气法收集 |
| D | 分离乙酸乙酯和饱和碳酸钠溶液 | 从分液漏斗上口倒出有机层,再从下口放出水层 |
| A. | A | B. | B | C. | C | D. | D |
1.下列式子为分子式的是( )
| A. | NH4Cl | B. | Cu | C. | SiO2 | D. | I2 |
18.分子组成为C9H12苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是( )
| A. | 该有机物的一溴代物最多有6种同分异构体 | |
| B. | 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 | |
| C. | 该有机物分子中的所有原子可能在同一平面上 | |
| D. | 该有机物不能发生加成反应,但能发生取代反应 |
5.下列对碱金属性质的叙述中,正确的是( )
| A. | 单质的熔沸点随着原子序数的增加而升高 | |
| B. | 碱金属单质与水剧烈反应生成碱和氢气 | |
| C. | 单质在空气中燃烧生成的都是过氧化物 | |
| D. | 都是银白色的软金属,密度都较小 |
19.如图实验装置和试剂的选用或操作都正确的是( )
| A. |  除去NO中的NO2 | B. |  铁制品表面镀锌 | C. |  稀释浓硫酸 | D. |  制备少量O2 |
20.下列有关物质的性质或应用的说法不正确的是( )
| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |