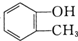
题目内容
4.利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(N2)=1.875×10-4mol•L-1•s-1 | |
| B. | 在该温度下,反应的平衡常数K=5 | |
| C. | 若将容积缩小为原来的一半,NO转化率大于90% | |
| D. | 使用催化剂可以提高单位时间CO和NO的处理量 |
分析 A.2s内△c(NO)=(1-0.25)×10-3 mol•L-1=7.5×10-4 mol•L-1,则△c(N2)=$\frac{1}{2}$△c(NO)=3.75×10-4 mol•L-1,再根据v=$\frac{△c}{△t}$计算v(N2);
B.4s时处于平衡状态,计算平衡常二氧化碳、氮气浓度,再根据K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$计算平衡常数;
C.原平衡时NO转化率为$\frac{(1-0.1)×1{0}^{-3}mol/L}{1×1{0}^{-3}mol/L}$=90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大;
D.使用催化剂加快反应速率.
解答 解:A.2s内△c(NO)=(1-0.25)×10-3 mol•L-1=7.5×10-4 mol•L-1,则△c(N2)=$\frac{1}{2}$△c(NO)=3.75×10-4 mol•L-1,则v(N2)=$\frac{3.75×1{0}^{-4}mol/L}{2s}$=1.875×10-4mol•L-1•s-1,故A正确;
B.4s时处于平衡状态,平衡时NO为1.0×10-3 mol•L-1,则:
2NO(g)+2CO(g)?2CO2(g)+N2(g)
起始量(×10-3 mol•L-1):1 3.6 0 0
变化量(×10-3 mol•L-1):0.9 0.9 0.9 0.45
平衡量(×10-3 mol•L-1):0.1 2.7 0.9 0.45
则平衡常数K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{(0.{9×1{0}^{-3})}^{2}×0.45×1{0}^{-3}}{(0.1×1{0}^{-3})^{2}×(2.7×1{0}^{-3})^{2}}$=5000,故B错误;
C.原平衡时NO转化率为$\frac{(1-0.1)×1{0}^{-3}mol/L}{1×1{0}^{-3}mol/L}$=90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大,故新平衡时NO转化率大于90%,故C正确;
D.使用催化剂加快反应速率,可以提高单位时间CO和NO的处理量,故D正确,
故选:B.
点评 本题考查化学平衡计算与影响因素、反应速率计算与含义、化学平衡常数等,难度不大,注意三段式在化学平衡计算中应用.

| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
| B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
| C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
| D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氢氧化铝 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 硫酸钠 |
| A | B | C | D | |
| 方案 |  | 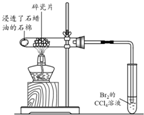 |  | 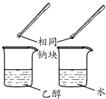 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 丙烯的实验式 C3H6 | |
| B. | 镁离子的结构示意图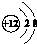 | |
| C. | CO2的电子式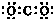 | |
| D. | 中子数为18的氯原子符号${\;}_{17}^{18}$Cl |
| A. |  火炬燃烧 | B. |  风力发电 | C. |  粮食酿醋 | D. |  高炉炼铁 |
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学,使光学显微镜分辨率步入纳米时代.利用此类光学显微镜可以具有丁达尔效应的分散系中分散质 | |
| D. | 酸碱指示剂变色、煤的液化、海水提取溴、焰色反应都涉及化学变化 |
 与
与
 和
和
 和
和