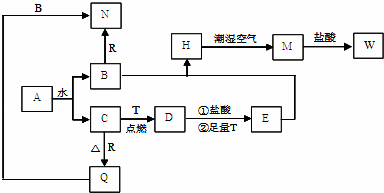
题目内容
14.利用图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
| B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
| C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
| D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫与高锰酸钾发生氧化还原反应;
B.浓盐酸与二氧化锰应在加热条件下反应生成氯气;
C.碳酸酸性比盐酸弱,二氧化碳与氯化钙溶液不反应;
D.反应生成二氧化硫,浓硫酸表现出氧化性.
解答 解:A.二氧化硫与高锰酸钾发生氧化还原反应,二氧化硫表现还原性,故A错误;
B.浓盐酸与二氧化锰应在加热条件下反应生成氯气,在不加热条件下没有氯气生成,FeBr2溶液不变色,故B错误;
C.碳酸酸性比盐酸弱,二氧化碳与氯化钙溶液不反应,CaCl2溶液无明显变化,故C正确;
D.蔗糖被碳化,浓硫酸表现脱水性,反应生成二氧化硫,浓硫酸表现出氧化性,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、氧化还原反应等,把握化学反应原理及实验装置中的反应为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
4.从1897年英国首次使用氯气对给水管网消毒以来,氯气用于自来水消毒已经经历了100多年的历史.目前,我国大多数城市仍然采用氯气消毒法对自来水进行净化、消毒.氯气之所以长期用于自来水消毒,原因是( )
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
5.某有机物的蒸气完全燃烧时需要3倍于其体积的氧气,产生2倍于其体积的CO2,该有机物可能是( )
| A. | CH3CH3 | B. | CH3CH2OH | C. | CH3CHO | D. | CH3COOH |
9.下列关于硝酸的认识中,正确的是( )
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 硝酸与金属反应时,只表现出氧化性 |
6.常温常压下为无色液体,而且密度大于水的是( )
| A. | 乙醇 | B. | 一氯甲烷 | C. | 溴苯 | D. | 乙酸乙酯 |
3.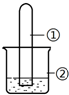 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
4.利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
下列说法中,不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(N2)=1.875×10-4mol•L-1•s-1 | |
| B. | 在该温度下,反应的平衡常数K=5 | |
| C. | 若将容积缩小为原来的一半,NO转化率大于90% | |
| D. | 使用催化剂可以提高单位时间CO和NO的处理量 |