题目内容
14.下列有关叙述正确的是( )| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学,使光学显微镜分辨率步入纳米时代.利用此类光学显微镜可以具有丁达尔效应的分散系中分散质 | |
| D. | 酸碱指示剂变色、煤的液化、海水提取溴、焰色反应都涉及化学变化 |
分析 A.碳纤维是由有机纤维经碳化及石墨化处理而得到的微晶石墨材料,不属于新型有机高分子材料;
B.铝性质活泼,不能通过氢气等还原剂从氧化铝中获取铝;
C.依据2014年诺贝尔化学奖获得者及其贡献解答;
D.焰色反应属于元素的物理性质.
解答 解:A.碳纤维是由有机纤维经碳化及石墨化处理而得到的微晶石墨材料,不属于新型有机高分子材料,故A错误;
B.铝的还原性强于氢气,不能通过氢气等还原剂从氧化铝中获取铝,通常用电解氧化铝法制取,故B错误;
C..2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察具有丁达尔效应的分散系中分散质,故C正确;
D.焰色反应属于元素的物理性质,故D错误;
故选:C.
点评 本题为综合题,涉及常见的材料及性能、金属的冶炼、物理性质与化学性质,掌握基础是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
相关题目
4.利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
下列说法中,不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(N2)=1.875×10-4mol•L-1•s-1 | |
| B. | 在该温度下,反应的平衡常数K=5 | |
| C. | 若将容积缩小为原来的一半,NO转化率大于90% | |
| D. | 使用催化剂可以提高单位时间CO和NO的处理量 |
2.下列有关能量的说法正确的是( )
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
9.下列说法不正确的是( )
| A. | 上海世博会很多场馆的外墙使用的非晶体薄膜,以充分利用天阳能,体现低碳经济 | |
| B. | 金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 | |
| C. | 若在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 常温时,某可逆反应的平衡常数越大则其反应速率就越快 |
19.室温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
6.下列说法正确的是( )
| A. | 葡萄糖可通过酒化酶水解生成酒精 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 向植物油中加入酸性高锰酸钾紫色溶液,振荡后,酸性高锰酸钾溶液颜色褪去 | |
| D. | 淀粉溶液与稀硫酸溶液共热,再加入新制氢氧化铜悬浊液加热,无红色沉淀,则可证明淀粉没有水解 |
3.(1)某学生进行中和热测定,取用50mL0.50mol•L-1的HCl和50mL0.55mol•L-1的Na0H溶液(密度都是1g.cm-3).实验后得到以下数据:
(中和后生成的溶液的比热容为4.18J•g-1℃-1)请替该同学计算出中和热的平均值:-52.25kJ/mol.
(2)该学生测得的数据比理论值低(填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
A.溶液混合后未及时盖好热计杯盖 B.倾倒溶液太快,有少量溅出烧杯.
| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)该学生测得的数据比理论值低(填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
A.溶液混合后未及时盖好热计杯盖 B.倾倒溶液太快,有少量溅出烧杯.
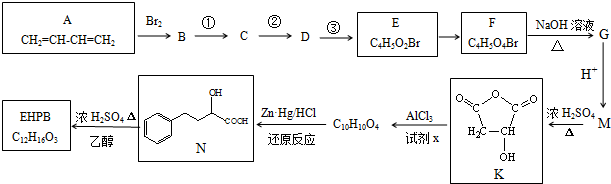
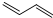 +Cl2$\stackrel{1,2-加成}{→}$
+Cl2$\stackrel{1,2-加成}{→}$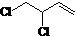 $\stackrel{1,4-加成}{→}$
$\stackrel{1,4-加成}{→}$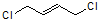
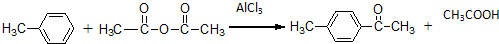
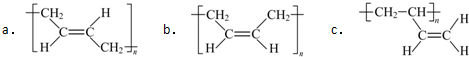
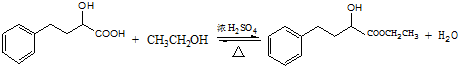 .
.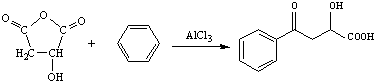 .
. .
.