题目内容
12.碳和氮的化合物与人类生产、生活密切相关.
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180~200℃}^{50~80℃}$Ni(CO)4(g),△H<0;
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.下列说法正确的是C(填字母编号).
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,△H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-Q1 kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-Q2 kJ•mol-1
则SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2Q1-Q2) kJ•mol-1;
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系>;
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为$\frac{1}{144}$(最简分数形式);
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-=N2O5;若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为224L.
分析 (1)A.因Ni是固体,改变用量对反应物的转化率无影响;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变;
C.根据外界条件和该反应本身的特点进行分析;
D.根据不同物质的速率关系判断可逆反应时,应当一正一逆,速率之比等于系数比;
(2)分析目标反应和已知反应,运用盖斯定律即可求得目标反应的△H;
(3)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
②700℃时,在压强为P2时,由图象知NO平衡转化率为20%,则反应消耗NO2mol,氧气为1mol,生成二氧化氮为2mol,根据平衡时浓度的幂次方之积之比计算K;
(4)据题意,根据通入气体判断两极,电极反应式和电池反应式,根据电池总反应4NO2+O2=2N2O5,求出消耗O2的量.
解答 解:(1)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;
C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;
D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;
故答案为:C;
(2)根据已知:①CO (g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q1 kJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1
则运用盖斯定律,SO2(g)+2CO(g)═S(s)+2CO2(g)可由①×2-②得到,则△H=-(2Q1-Q2) kJ•mol-1,
故答案为:-(2Q1-Q2) kJ•mol-1;
(3)①相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
②700℃时,在压强为P2时,由图象知NO平衡转化率为20%,则反应消耗NO2mol,氧气为1mol,生成二氧化氮为2mol,平衡时NO为8mol,氧气为9mol,生成二氧化氮为2mol,则K=$\frac{{2}^{2}}{{8}^{2}×9}$=$\frac{1}{144}$;
故答案为:$\frac{1}{144}$;
(4)据题意,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,电极反应为:NO2+NO3--e-=N2O5,根据电池总反应4NO2+O2=2N2O5,收集到20molN2O5需消耗O2为10mol,标准状况下体积为224L.
故答案为:NO2+NO3--e-=N2O5;224.
点评 本题以碳和氮的化合物为载体考查化学平衡、热化学方程式及电化学的相关知识,综合性较强,题目难度中等.

| A. | 铜和稀硝酸的反应:Cu2++4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 氯气与水反应:Fe3++Cu═Fe2++Cu2+ | |
| C. | 氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
(1)下列说法能说明上述反应向正反应方向进行的是bd(填序号).
a.单位时间内生成2a mol NH3的同时生成3a mol H2
b.单位时间内生成6a mol N-H键的同时生成2a mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:根据表中数据计算:
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
②根据计算可得m=0.6,0~2h内NH3的平均反应速率为0.15mol/(L•h),.
③此温度下反应:2NH3?N2+3H2的化学平衡常数K=6.75.

| A. | ④>②>①>③ | B. | ①>④>②>③ | C. | ④>②>③>① | D. | ③>②>④>① |
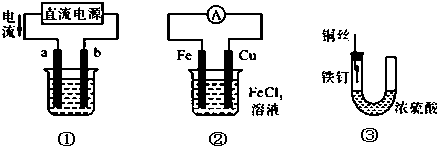
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
